par Samantha Flores Il y a 4 années
420
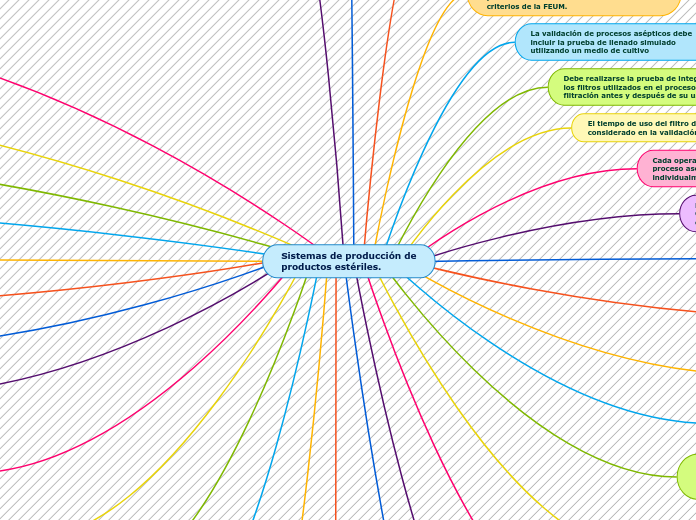
Sistemas de producción de productos estériles.
La producción de productos farmacéuticos estériles requiere un entorno controlado y el uso de tecnologías avanzadas como el soplado/llenado/sellado. Es crucial validar tanto la limpieza como la esterilización del equipo, y evaluar el entorno en que se encuentra.