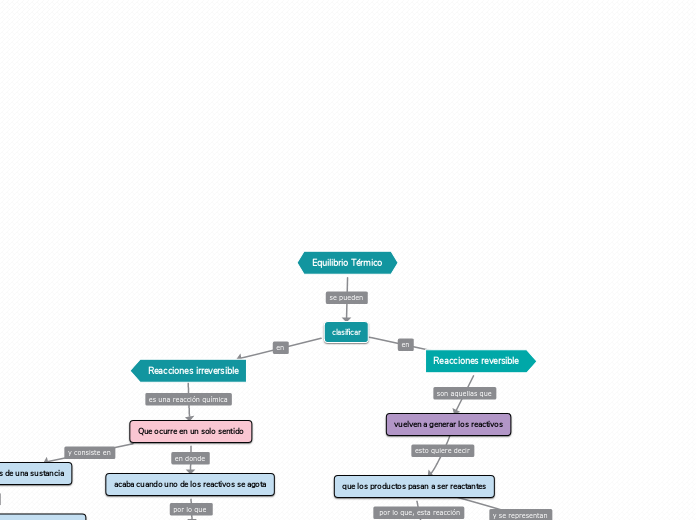
a SANTILLAN DOMINGUEZ CARLOS HAZIEL 2 éve
132
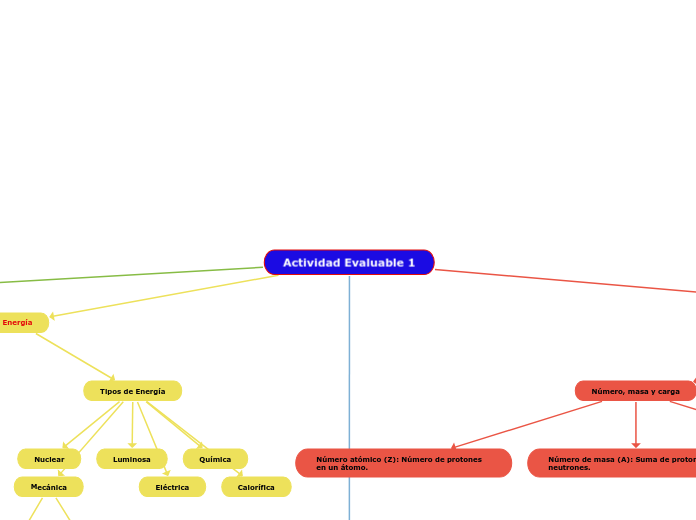
Actividad Evaluable 1
La configuración electrónica de un átomo describe cómo los electrones se organizan en diferentes orbitales. Cada tipo de orbital tiene una capacidad máxima de electrones: 2 en s, 6 en p, 10 en d y 14 en f.