ELECTROQUIMICA
REACCIONES REDOX
CUANDO OCURREN
REDUCCION
genera
GANANCIA DE ELECTRONES
provocando
DISMINUCION DEL NUMERO
DE OXIDACION
OXIDACION
por
PERDIDA DE ELECTRONES
causa
AUMENTO DEL NUMERO
DE OXIDACION
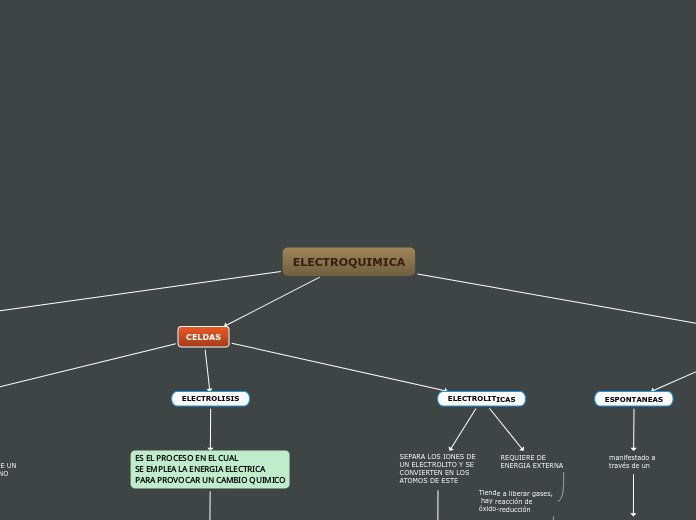
ESPONTANEAS
manifestado a
través de un
FLUJO DE ELECTRONES
lo cual constituye la
CORRIENTE EXTERNA
CELDAS
ELECTROLITICAS
REQUIERE DE
ENERGIA EXTERNA
Tiende a liberar gases,
hay reacción de
óxido-reducción
reacción química
no espontanea
se necesita un recipiente
con dos electrodos
los electrolitos deben ir
conectados a la fuente
de energia
son de material inerte
SEPARA LOS IONES DE
UN ELECTROLITO Y SE
CONVIERTEN EN LOS
ATOMOS DE ESTE
funcionan con
energia quimica
ELECTROLISIS
ES EL PROCESO EN EL CUAL
SE EMPLEA LA ENERGIA ELECTRICA
PARA PROVOCAR UN CAMBIO QUIMICO
TIPOS
ELECTROLISIS DE
SOLUCIONES ACUOSAS
ELECREOLISIS CON
ELECTRODOS ACTIVOS
ELECREOLISIS DE SALES
FUNDIDAS
GALVALICAS O
VOLTAICAS
REQUIEREE DE UN
PUENTE SALINO
existe una reacción
de oxido-reducción
reacción química
espontanea
PRODUCE ENERGIA
ELECTRICA
funcionan con una
diferencia de potencial
entrelos compuestos
quimicos
se puede interpretar
como lo que esta dentro
de una bateria
deben ser metales
requiere de dos recipientes
con dos electrolitos
se conectan con
un alambre externo
tiene un puente salino
PRINCIPIOS
FISICOQUIMICOS
CONDICIONES
ESTANDAR
1 ATM
1 M
25°C