a SALWA MILENA VERGARA ARIZA 2 éve
240
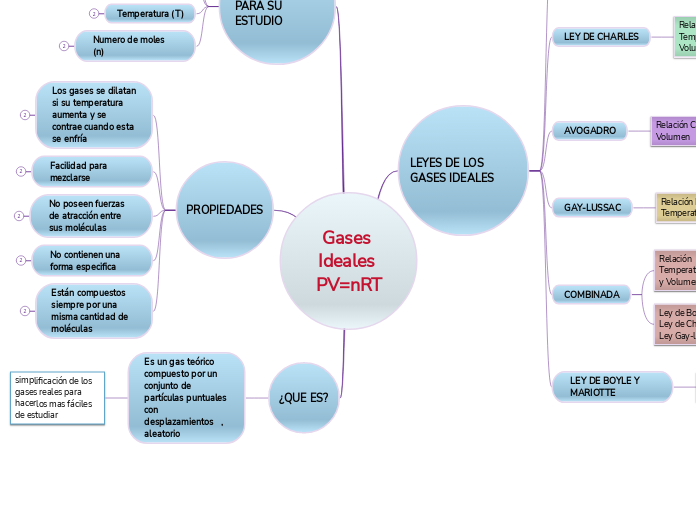
Gases Ideales PV=nRT
Los gases ideales son un concepto fundamental en la química y la física, utilizado para simplificar el estudio de los gases reales. Están compuestos por partículas puntuales que se mueven de manera aleatoria, sin fuerzas de atracción entre ellas, y siempre contienen la misma cantidad de moléculas.