Gases Ideales PV=nRT
.
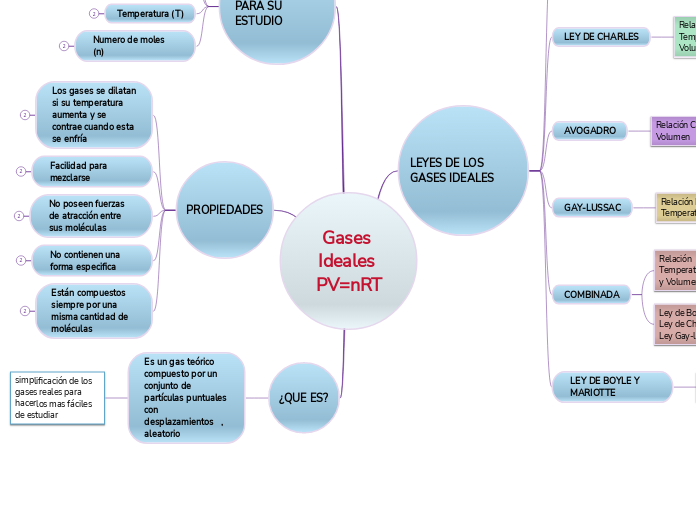
¿QUE ES?
Es un gas teórico compuesto por un conjunto de partículas puntuales con desplazamientos , aleatorio
simplificación de los gases reales para hacerlos mas fáciles de estudiar
PROPIEDADES
Están compuestos siempre por una misma cantidad de moléculas
No contienen una forma especifica
No poseen fuerzas de atracción entre sus moléculas
Facilidad para mezclarse
Los gases se dilatan si su temperatura aumenta y se contrae cuando esta se enfría
4 VARIABLES PARA SU ESTUDIO
Numero de moles (n)
Temperatura (T)
Volumen (V)
Presión (P)
Add your text
LEYES DE LOS GASES IDEALES
LEY DE BOYLE Y MARIOTTE
Relación Presión-Volumen
Presión y volumen son inversamente proporcional si se mantiene constante su temperatura
P1 . V1 = P2 . V2 P ∝ 1/V n,T= constante
COMBINADA
Ley de Boyle Ley de Charles Ley Gay-lussac
Relación Temperatura, Presión y Volumen
Volumen directamente proporcional a su temperatura
P1V1T1 = P2V2T2 n= constante
GAY-LUSSAC
Relación Presión-Temperatura
Presión directamente proporcional a su temperatura a un volumen constante
P ∝ T n, V = constante
AVOGADRO
Relación Cantidad-Volumen
Volumen de un gas, mantenido a temperatura y presión constante es directamente proporcional al numero de moles
V ∝ n PT=constante
LEY DE CHARLES
Relación Temperatura-Volumen
Volumen de una cantidad fija de gas mantenida a presión constante es directamente proporcional a su temperatura
V ∝ T n P=constante
LEY DE BOYLE
Relación Presión - Volumen
Medidas inversamente proporcional, una disminuye cuando la otra aumenta
V ∝ 1/P n, T=constante