a First Last 4 éve
434
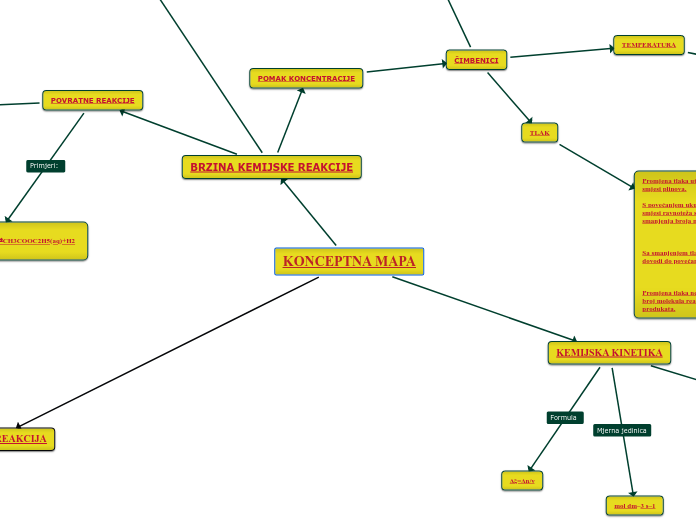
KONCEPTNA MAPA
Chemická kinetika se zabývá studiem rychlosti chemických reakcí a faktory, které na ni mají vliv. K hlavním faktorům patří koncentrace reaktantů, teplota, povrch reaktantů a přítomnost katalyzátorů.
a First Last 4 éve
434

Még több ilyen
TLAK
Promjena tlaka utječe na pomak ravnoteže u reakcijskoj smjesi plinova. S povećanjem ukupnog tlaka u plinovitoj reakcijskoj smjesi ravnoteža se pomiče u smjeru koji dovodi do smanjenja broja molekula. Sa smanjenjem tlaka ravnoteža se pomiče u smjeru koji dovodi do povećanja broja molekula. Promjena tlaka ne utječe na pomak ravnoteže kada je broj molekula reaktanata jednak broju molekula produkata.
Ako je reakcija egzotermna, hlađenjem se ravnoteža reakcije pomiče prema produktima, dok se zagrijavanjem egzotermne reakcije ravnoteža pomiče prema reaktantima. Za endotermne reakcije vrijedi obrnuto. grijanjem se ravnoteža pomiče prema produktima, a hlađenjem prema reaktantima
PROMJENA KONCENTRACIJE REAKTANATA ILI PRODUKATA
S povećanjem koncentracije reaktanata ili uklanjanjem produkta iz reakcijske smjese, ravnoteža se pomiče u smjeru stvaranja produkata. Pomak ravnoteže u smjeru reaktanata u nekoj reakcijskoj smjesi postiže se suprotnim djelovanjem tj. smanjenjem koncentracije reaktanata ili povećanjem koncentracije produkata
Kemijska reakcija biti će brža ako su reaktanti u krutom agregacijskom stanju
omogućuje da se dovoljan broj uspješnih sudara postigne pri nižoj aktivacijskoj energiji
Što je veća površina reaktanta to je brzina reakcije veća
Rastom temperature dolazi do rasta brzine kemijske reakcije
Što je koncentracija reaktanata veća broj mogućih uspješnih sudara je veći
Fe2O3 + 2Al -> Al2O3 + 2Fe
Reaktanti su Fe2O3 i 2Al, a produkti su Al2O3 i 2Fe
a=1, b=2, c=1, d=2
a, b, c i d predstavljaju stehiometrijske koeficijente A, B, C i D.