Modelos Atômicos
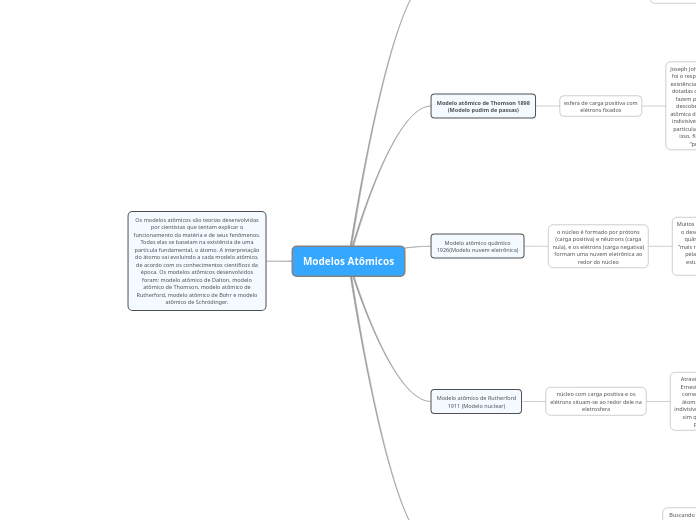
Os modelos atômicos são teorias desenvolvidas
por cientistas que tentam explicar o
funcionamento da matéria e de seus fenômenos.
Todas elas se baseiam na existência de uma
partícula fundamental, o átomo. A interpretação
do átomo vai evoluindo a cada modelo atômico,
de acordo com os conhecimentos científicos da
época. Os modelos atômicos desenvolvidos
foram: modelo atômico de Dalton, modelo
atômico de Thomson, modelo atômico de
Rutherford, modelo atômico de Bohr e modelo
atômico de Schrödinger.
Modelo atômico de Bohr 1913
(Modelo planetário)
os elétrons se movimentam em
camadas circulares fixas ao redor
do núcleo
Buscando explicar o porquê dos
elementos emitirem cores
características quando expostos a
algumas condições e baseado no
modelo atômico de Rutherford,
Niels Bohr (1885-1962) propôs
uma teoria atômica que explicava
a emissão de luz em certas
frequências.
Para ir para um nível mais externo
o elétron deve absorver energia.
Ao retornar para uma camada mais
próxima do núcleo, o elétron libera
energia
As camadas ao redor do núcleo apresentam valores de energia específicos
Pontos negativos: Não pode-se
afirmar que os elétrons realizam
uma trajetória ao redor do núcleo
em posições fixas como os
planetas ao redor do Sol
Os elétrons movimentam-se nas
camadas ao redor do núcleo
Modelo atômico de Rutherford
1911 (Modelo nuclear)
núcleo com carga positiva e os
elétrons situam-se ao redor dele na
eletrosfera
Através de seus experimentos
Ernest Rutherford (1871‑1937)
conseguiu demonstrar que o
átomo não era uma partícula
indivisível como se acreditava, mas
sim que ele era formado por
partículas menores.
Os elétrons são mais leves e se
localizam ao redor do núcleo,
região que contém muitos espaços
vazios
A massa de um átomo se
concentra na sua região central
Pontos negativos: O núcleo
atômico não possui apenas
partículas de carga positiva, mas
existem também outras partículas
subatômicas, os nêutrons,
descobertos por James Chadwick
em 1932. Além disso, o modelo
proposto por Rutherford não
explicava a emissão de luz pelos
átomos
O átomo apresenta uma região
central com alta concentração de
carga positiva
Modelo atômico quântico
1926(Modelo nuvem eletrônica)
o núcleo é formado por prótons
(carga positiva) e nêutrons (carga
nula), e os elétrons (carga negativa)
formam uma nuvem eletrônica ao
redor do núcleo
Muitos cientistas contribuíram para
o desenvolvimento da mecânica
quântica, que tenta explicar a
"mais real" estrutura de um átomo
pela combinação de diversos
estudos e, por isso, é o mais
complexo
A posição exata de um elétron não
pode ser definida. O que é feito
são cálculos que determinam a
probabilidade da região que um
elétron estará em dado tempo
Os elétrons se movimentam em
orbitais, num espaço
tridimensional
Os elétrons formam uma nuvem
eletrônica ao redor do núcleo
O núcleo é formado por prótons e
nêutrons. Como apenas os prótons
possuem carga, o núcleo é
carregado positivamente
Modelo atômico de Thomson 1898
(Modelo pudim de passas)
esfera de carga positiva com
elétrons fixados
Joseph John Thomson (1856‑1940)
foi o responsável por descobrir a
existência dos elétrons, partículas
dotadas de carga negativa e que
fazem parte dos átomos. Essa
descoberta derrubou a teoria
atômica de Dalton, que o átomo é
indivisível, mas sim formado por
partículas ainda menores e, por
isso, ficou conhecido como
“pudim de passas”.
Existe uma repulsão entre os
elétrons distribuídos nos átomos
Os elétrons fixam-se em uma
superfície carregada positivamente
Pontos negativos: Embora
Thomson levasse em consideração
a existência dos elétrons, o átomo
não é uma esfera positiva, mas sim
dotada de partículas com cargas
positivas, os prótons, identificados
em 1886 pelo cientista Eugene
Goldstein e confirmados
posteriormente por Ernest
Rutherford
O átomo é eletricamente neutro
Modelo atômico de Dalto 1803
(Modelo bola de bilhar)
esfera maciça, indivisível e
indestrutível
A primeira tentativa reconhecida
de descrever os átomos partiu do
cientista inglês John Dalton (1766-1844)
em um modelo que ficou
popularmente conhecido como
“bola de bilhar”.
As substâncias são resultado de
uma reação química, que consiste
na recombinação dos átomos
Os átomos de um elemento
químico são idênticos no tamanho
e nas características, já os de
elementos químicos distintos são
diferentes
Pontos negativos: Como os
elétrons ainda não eram
conhecidos quando Dalton
formulou sua teoria, essas
partículas, que hoje sabemos que
fazem parte dos átomos, não
foram consideradas
Todas as substâncias são formadas
por átomos