Turbeculose
CAMPOS, Hisbello. MYCOBACTERIUM TUBERCULOSIS RESISTENTE: DE ONDE VEM ARESISTÊNCIA ?. Scielo, 1 - jan/jun – 1999. Disponível em: http://scielo.iec.gov.br/pdf/bps/v7n1/v7n1a06.pdf. Acesso em: 25 de maio de 2021
MELO PEREIRA, Alyne. Georreferenciamento e Genotipagem de Mycobacterium tuberculosis isolados de pacientes atendidos na cidade de Goiânia – GO pelo método de MIRU-VNTR. 2012. Disponível em: https://files.cercomp.ufg.br/weby/up/59/o/Alyne_M._Pereira_-_2012.pdf?1338297362. Acesso em: 25 de maio de 2021
MARQUES DE OLIVEIRA, Daniel. Mycobacterium Tuberculosis e a resistência do bacilo de Koch. 2013. Disponível em: https://bdigital.ufp.pt/bitstream/10284/5525/1/PPG_19627.pdf . Acesso em: 25 de maio de 2021
LINDENAU, Juliana. A importancia dos fatores genéticos do hospedeiro na suscetibilidade a doenças infecciosas introduzidas em populações nativas sul americanas - turbeculose nos aché , Porto Alegre, p. 20-26. Disponível em: https://lume.ufrgs.br/bitstream/handle/10183/142447/000989119.pdf;jsessionid=D73F45E3A5CEE31E602C29D3C2BEA827?sequence=1 Acesso em: 21 de maio de 2021
ROSEMBERG, José. Mecanismo imunitário da tuberculose síntese e atualização, Rio de Janeiro, v,9 n.1, p.1-26, janeiro, 2001. Disponível em: http://scielo.iec.gov.br/scielo.php?script=sci_arttext&pid=S0103-460X2001000100005
Géssica Marat Almeida
Maria Eveline Mesquita
Vinícios Monteiro Rodrigues
Wanessa Gabriely
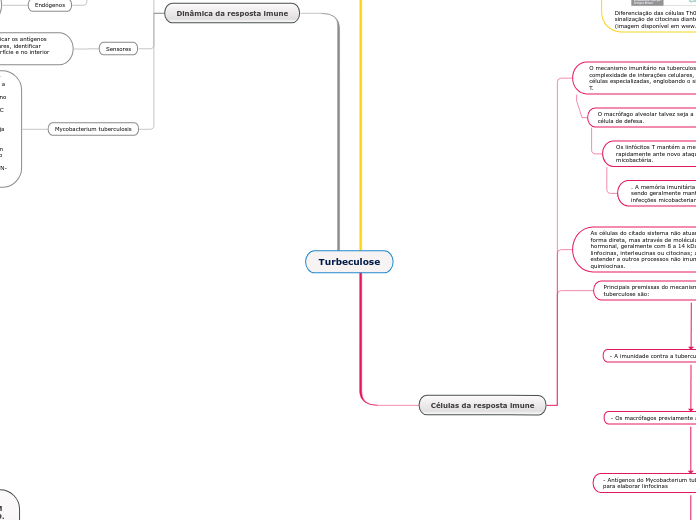
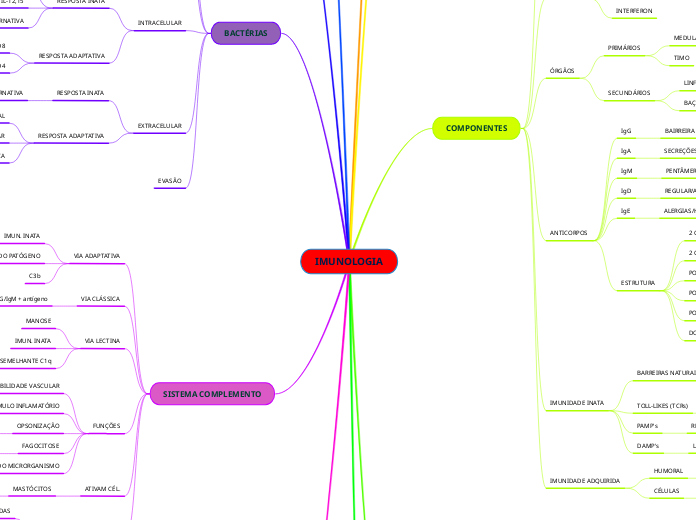
Dinâmica da resposta imune
Mycobacterium tuberculosis
Os macrófagos,no pulmão, fagocitam e ficam infectados por não conseguir destruir o mycobacterium. Ao mesmo tempo, a célula dendrítica também está fagocitando e expressando o peptídeo desse mycobacterium em um MHC de classe dois, no intuito de apresentar o antígeno, migra para o linfonodo, entrando em contato com o Thelper virgem por meio do MHC II com o TCR (primeiro sinal). A partir daí ocorre o segundo sinal por meio da ligação da molécula B7 (contida na célula dendrítica) e o C28 contido no Thelper, fazendo com que haja tanto uma expressão de uma nova molécula no Thelper (CD40L), como também faz com que esse Thelper (considerado ativado) expresse receptores de IL-2 e também passe a produzir uma maior quartidade de IL-2, ocasionando uma expansão clonal , resultando em Th1, que se ligam ao macrófago infectado e reconhece o patógeno, produzindo IFN- y, mediador implicado na proteção contra a infecção pelo M.tuberculosis, essencial para a ativação dos macrófagos.
Sensores
Reconhecer os sinais dos indutores, identificar os antígenos com base em suas características moleculares, identificar PAMPs e DAMPs e estão presentes na superfície e no interior de todas as células.
Indutores
Endógenos
Denominados alarminas ou "sinais de perigo", são constituintes de células normais que podem ser liberados no meio extracelular durante estresse celular ou danos teciduais. Também são mecanismos internos chamados de DAMP (padrão molecular associado ao dano).
Exógenos
Fatores de origem não microbiana.
Incluem alérgenos, irritantes, corpos estranhos e compostos tóxicos são detectados por mimetizarem a atividade de virulência de parasitas ou por atuar como agentes irritantes da mucosa.
Fatores de virulência.
Não são detectados por receptores específicos, mas pelos efeitos de sua atividade, é capaz de desencadear uma resposta inflamatória.
Padrões moleculares associados a patogenos ou PAMPS.
PAMPS é um conjunto limitado e definido de padrões moleculares conservados presente em todos os microorganismos de uma determinada classe e reconhecidos por um conjunto de receptores correspondentes no hospedeiro
A origem da TB pode ser tanto endógena, por reativação de um foco quiescente, quanto exógena, a partir de uma nova contaminação.
Células da resposta imune
Principais premissas do mecanismo imunitário contra a tuberculose são:
- A imunidade contra a tuberculose é mediada por células.
- Os macrófagos previamente ativados matam os bacilos.
- Antígenos do Mycobacterium tuberculosis ativam linfáticos T para elaborar linfocinas
- As linfocinas atraem os macrófagos ao sítio da infecção e os ativam para matarem as micobactérias.
- A imunidade contra a tuberculose pode ser suprimida pela depleção das células T e restaurada por agentes que recompõem essas células.
- A imunidade contra a tuberculose pode ser transferida experimentalmente de organismo para organismo, transplantando células T .
- A memória imunitária das células T se esvanece com o tempo e, nos casos de sua transferência passiva, ela perdura durante o tempo em que permanecem vivas.
As células do citado sistema não atuam propriamente de forma direta, mas através de moléculas, algumas de natureza hormonal, geralmente com 8 a 14 kDa, denominadas linfocinas, interleucinas ou citocinas; algumas podem se estender a outros processos não imunitários, constituindo as quimiocinas.
Os leucócitos polimorfonucleares têm grande capacidade de fagocitar o Mycobacterium tuberculosis, porém sem nenhum poder de destruí-lo.
Se não são englobados pelos macrófagos, exercem papel prejudicial, pois as micobactérias são transportadas para diversos sítios do organismo.
As linfocinas não têm função
imunológica direta, pois atuam através o macrófago.
Elas atraem os macrófagos ao local da implantação da micobactéria e os ativam para matar o M. tuberculosis.
O mecanismo imunitário na tuberculose encerra grande complexidade de interações celulares, notadamente das células especializadas, englobando o sistema macrófago-célula T.
O macrófago alveolar talvez seja a principal
célula de defesa.
Os linfócitos T mantém a memória da imunidade reagindo rapidamente ante novo ataque da
micobactéria.
. A memória imunitária da célula T se esvai com o tempo, sendo geralmente mantida com novas
infecções micobacterianas.
Resposta imune
Adaptativa
Diferenciação das células Th0 em Th1 ou Th2 através da sinalização de citocinas diante de exposição a antígenos (imagem disponível em www.bd.com).
Células Th1 específicas estão presentes no sítio de infecção de pacientes com tuberculose. Além disso, observou-se a presença de células Th17 e Th22. Isso demonstra que essas células também podem ter um importante papel na imunidade contra Mtb
As células Th1 secretam citocinas como interferon gama e ativam vias inflamatórias principalmente através da ativação de macrófagos.
Em humanos as células Th17 originam-se em resposta à combinação de fator de transformação do crescimento beta (TGF-β) e citocinas pró- inflamatórias (IL1-β, IL-6, IL-21, IL-23)
As células Th22 são aquelas que produzem citocinas como a IL-22, IL-26 e IL-13, das quais a IL-22 é a mais importante do ponto de vista funcional.
As células Th9 caracterizam-se por produzir IL-9 e se desenvolvem a partir de precursores CD4+ através do efeito combinado de TGF-β e IL-4. Essas células são capazes de induzir inflamação tecidual e contribuir para o desenvolvimento de doenças alérgicas.
A diferenciação das células Th0 em Th1 ou Th2 é direcionada a partir da expressão de um conjunto de citocinas.
Resposta Th2: é responsável pela imunidade mediada por anticorpos.
Resposta Th1: é responsável pela imunidade mediada pelas células.
O combate ao Mtb ocorre na presença de predominância de resposta do tipo Th1.
Dentre as citocinas relacionadas com a predominância desta resposta podemos destacar a IL-2, IL-8, IL-12, IFN-γ e TNF-β. Enquanto que IL1-β, IL-4, IL-6 e IL-10 estão relacionadas com a predominância de um padrão Th2 de resposta imune.
As células Th2 secretam citocinas como as interleucinas 4 e 5, que regulam a formação de anticorpos através das células B, eosinófilos e outras vias.
Inata
Esquema demonstrando as vias que são ativadas por TLRs (imagem disponível em www.abcam.com).
Os TLRs precisam manter o sinal de ativação por um tempo ótimo, ou seja, até que as moléculas presentes nas vias de sinalização subsequentes sejam ativadas e desencadeiem uma adequada resposta celular, sem que o Mtb consiga ativar seus mecanismos de evasão. Para tanto, não somente os TLRs são importantes para um adequado combate ao Mtb, mas também as moléculas presentes nas vias de ativação subsequentes, conforme demonstrado na figura.
Ação dos TLRs é diretamente relacionada com o tempo de ativação de suas vias de sinalização.
Se essa ativação for:
Demasiadamente curta: não teremos uma resposta subsequente adequada.
Demasiadamente prolongada: os mecanismos de evasão do Mtb poderão desenvolver-se.
Dentre essas podemos citar
(a) manutenção da fusão fagolisossomal
(b) inibição de intermediários reativos de oxigênio e nitrogênio
(c) inibição da apoptose de macrófagos infectados
(d) interferência na apresentação de antígenos
Devido o papel importante do Mtb no reconhecimento da micobactéria e início de uma adequada resposta imune, as estratégias de evasão adotadas por ele acabam por afetar as vias de sinalização dos TLRs.
Mtb é capaz de modular a resposta imune de maneira a desenvolver um ambiente favorável para sua proliferação. Essa modulação pode ser ao nível de imunosupressão de células T, regulação da expressão de TLRs ou alteração na expressão de citocinas.
TLRs são os responsáveis pelo reconhecimento de antígenos derivados de Mtb, que levam à ativação de macrófagos e células dendríticas, assim como outras células do sistema imune inato.
expressos na superfície intracelular
TLR7, TLR8 e TLR9
expressos na superfície celular
TLR1, TLR2, TLR4, TLR5, TLR6, TLR10 e TLR12
A infecção por Mtb necessita de respostas imunes do tipo humoral e celular, e da imunidade mediada pelas células T através das células CD4+ e CD8+, para o combate ao desenvolvimento da doença após a infecção.
A resposta imune específica inicia-se com células T que migram para o foco da infecção, guiadas pelas citocinas produzidas pelas células infectadas.
O acúmulo de macrófagos, células T e outras células do hospedeiro (como as dendríticas e os fibroblastos) levam a formação do granuloma no sítio de infecção.
A formação do granuloma impede que o bacilo se disperse para o restante do tecido pulmonar e provém um microambiente para interações entre macrófagos e outras células do sistema imune e para as citocinas produzidas por essas células.
As células T CD4+ que produzem interferon gama (IFN-γ) reconhecem os macrófagos infectados que estão apresentando antígenos de Mtb e os matam.
Esquema demonstrando as diferentes interações entre moléculas do sistema imune para desenvolvimento do granuloma, tanto nas infecções latentes quanto na doença ativa.
(imagem disponível em Kaufmann et al., 2010).