da Nadia Castro mancano 4 anni
525
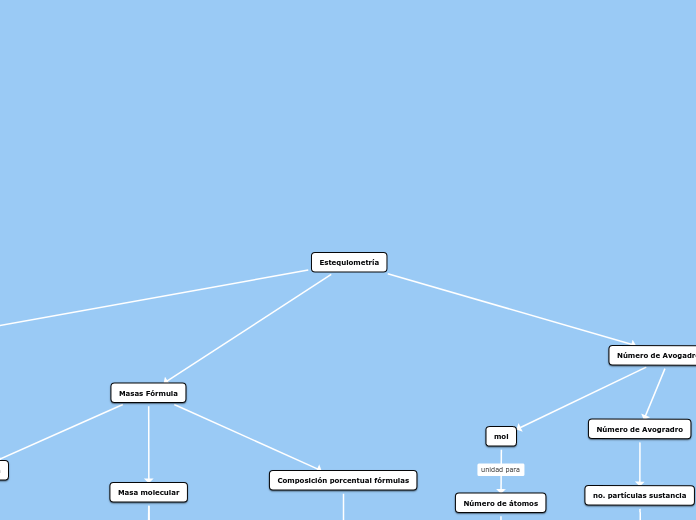
Estequiometría
La química estudia diversas reacciones y sus mecanismos, entre los cuales la estequiometría juega un papel fundamental al relacionar las cantidades de reactivos y productos en una reacción química.
da Nadia Castro mancano 4 anni
525

Più simili a questo
No. g y fórmula química
Ocupamos calcular
No. átomos elemento
No. moléculas
moles a gramos
No. moles y nombre sustancia
g de muestra
gramos a moles
Análisis
g sustancia y fórmula química
Calcular no. moles
mol de sustancia
NaCl
Masa molar (g/mol)
58.5 g/mol
son numéricamente igual
Masa fórmula (uma)
58.5 uma
en un mol
6.02 x 10ˆ23
NA
Amadeo Avogadro
Unidades recíprocas
6.02 x 10ˆ23 molˆ-1
y se lee
"por mol"
"mol inversa"
cantidad de materia
tantos objetos
no. átomos en 12 g
Carbono 12
contribuye cada elemento
sustancia
% = No. átomos x MA÷ MF * 100%
molécula
C6H1206
180.0 uma
átomos
fórmula química
Redondeamos MA a una cifra
uma
Reacciones rápidas
Producen una flama
O2 como reactivo
en nuestro cuerpo
Reacciones de oxidación
sustancia experimenta reacción
2 o más sustancias
un producto
A + B → C
metal + no metal
un sólido iónico