BIOSSINALIZAÇÃO
respostas em cada tipo de célula
DEPENDENTE DE CONTATO
SINÁPTICA
ENDÓCRINA
PARÁCRINA
transdução de sinais
seis tipos de receptores
nuclear
de adesão
canal iônico
guanilil-ciclase
tirosina-cinase
proteína G
Molécula-sinal
integração
adaptação
amplificação
proteínas, peptídeos,
aminoácidos, nucleotídeos...
receptor de um membrana celular (uma proteína), ativando segundos mensageiros intracelulares e por final moléculas efetoras
cascata de reações
Neurotransmissores, fatores de crescimento, hormônios, luz, toque mecânico, moléculas de superfície, sinais de desenvolvimento, componentes da matriz extracelular, antígenos, gustativos, odorantes, feromônios
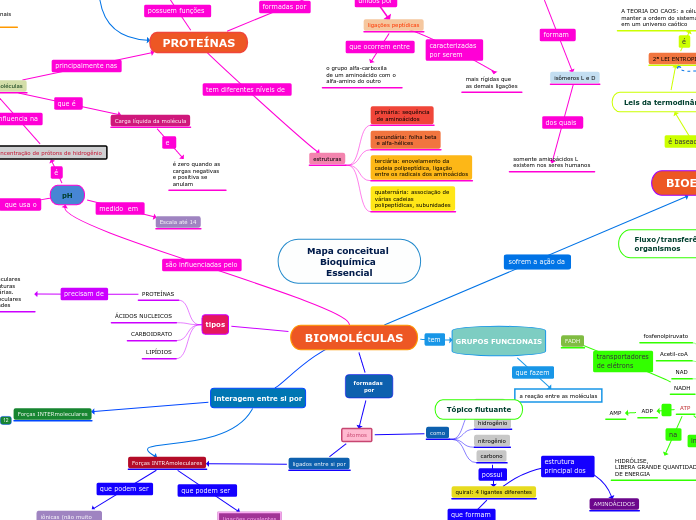
BIOMOLÉCULAS
pH
Ka= [H+][A-]/[HA]
quanto maior o valor de Ka,
mais forte é o ácido, pois há maior
liberação de H+, aumenta a
concentração de prótons,
diminui o pH e vice-versa
Concentração de prótons de hidrogênio
pH = - log [H+]
ionização das moléculas
Transporte, defesa, estrutural,
pressão osmótica, catalítica,
receptor celular, sinalizadora
estruturas
quaternária: associação de
várias cadeias
polipeptídicas, subunidades
terciária: enovelamento da
cadeia polipeptídica, ligação
entre os radicais dos aminoácidos
secundária: folha beta
e alfa-hélices
primária: sequência
de aminoácidos
aminoácidos
monomêros formados por
um carbono quiral ligado a
um grupo amino e carboxila,
e uma cadeia lateral, hidrogênio
isômeros L e D
somente aminoácidos L
existem nos seres humanos
códons de nucleotídeos do DNA
20 tipos de aminoácidos
mais alguns tipos presentes
em diferentes formas de vida
diferentes grupos R
aromáticos
básicos
especiais
ácidos
hidrofóbicos apolares
polares
influenciados pelo pH
nos grupos ionizáveis
ligações peptídicas
mais rígidas que
as demais ligações
o grupo alfa-carboxila
de um aminoácido com o
alfa-amino do outro
Carga líquida da molécula
é zero quando as cargas negativas e positiva se anulam
Protonar ou desprotonar
Escala até 14
tipos
LIPÍDIOS
CARBOIDRATO
ÁCIDOS NUCLEICOS
PROTEÍNAS
interações intermoleculares para formar as estruturas terciarias e quaternárias. Interações intramoleculares formam as subunidades
GRUPOS FUNCIONAIS
a reação entre as moléculas
formadas por
átomos
ligados entre si por
Forças INTRAmoleculares
ligações covalentes
compartilhamento de elétrons
iônicas (não muito comuns na bioquímica)
elétrons
como
carbono
quiral: 4 ligantes diferentes
AMINOÁCIDOS
estereoisômeros
especificidade
sítio de ligação em enzima e substrato
nitrogênio
hidrogênio
oxigênio
interagem entre si por
Forças INTERmoleculares
Ligação de hidrôgenio
é uma força inter ou intramolecular resultado de uma força atrativa de um átomo de hidrôgenio em covalência com um átomo muito negativo
íon- dipolo induzido
atração que ocorre quando um íon provoca um dipolo em uma molécula apolar por perturbação dos elétrons na espécie polar
íon-dipolo
atração entre íon e uma molécula que tem um dipolo (polar)
dipolo-dipolo induzido
quando uma molécula não polar se aproxima de uma molécula polar, a molécula polar provoca um dipolo na molécula apolar ou átomo, pois ocorre uma perturbação nos elétrons da espécie não polar
dipolo-dipolo
atração entre o positivo e negativo de moléculas polares, só acontece quando as moléculas estão próximas
dipolo induzido-dipolo induzido
atração entre dipolos de duas moléculas apolares diferentes causados pela distribuição da nuvem de elétrons de uma mesma molécula apolar responsável pela condensação e solidificação das substâncias em baixa temperatura
ENZIMAS
são alostéricas
catalíticas, específicas para
moléculas em que agem
sítio ativo onde
ligam os subtratos
produtos
Regulação Enzimática
modulação covalente
ativação de zimogênios
fosforilção e desfosforilação
inibidores
irreversíveis
reversíveis
incompetitivo
não competitivos/misto
competitivos
alosteria
ativadores ou inibidores
cooperatividade
catalisar a reação
nos dois sentidos
a quantidade de energia de ativação necessária (mas mesmo sem a enzima a reação acontece)
estado de transição que forma um complexo enzima-subtrato, (para isso ocorrer é necessário que existam interações)
não alteram a quantidade de energia livre
holoenzima
grupo prostético
cofatores: para serem funcionais
(como íons, Mg, Cu, Zn)
coenzimas, são como
os cofatores mas orgânicas
vitaminas
a coenzima piridoxal
fosfato derivado da
vitamina do complexo B
apoenzima: a parte
proteica da enzima,
inativa
nível estrutural
terciário e quaternário
BIOENERGÉTICA
Fluxo/transferência de energia nos organismos
energia química
moléculas transferidoras
ATP
TODAS AS CÉLULAS
CONSEGUEM USAR
HIDRÓLISE,
LIBERA GRANDE QUANTIDADE
DE ENERGIA
ADP
AMP
FADH
NAD
Acetil-coA
fosfenolpiruvato
Leis da termodinâmica
2ª LEI ENTROPIA
A TEORIA DO CAOS: a célula precisa de energia para
manter a ordem do sistema
em um universo caótico
1ª LEI: CONSERVAÇÃO
DE ENERGIA
ENERGIA LIVRE DE GIBBS
Keq: Constante de equilíbrio
EXERGÔNICA ou
ENDERGÔNICA
acoplamento de energia
reação
Energia Livre Padrão:
em condição padrão
alterada de acordo com a
concentração de reagentes
dentro da célula;
maneira de regular o METABOLISMO
Metabolismo
Respiração celular
Divide-se em
Anaeróbica
Aeróbica
Cadeia respiratória
Liberapor meio de
FADH2
NADH
Ciclo do ácido Ciclico
Ciclo de Krebs
Desidrogenase
Isocitrato desidrogenase
Cintratocintase
Glicólise
Fase glicolítica
Fase de Pagamento
A glicose já fosforilada é
utilizada dentro da célula
Fase preparatória
Captação do a glicose do meio extracelular
para o meio intracelular, por meio de
biossinalizadores de insulina, onde fatalmente
sera fosforilada
Define-se por
Transformação de matéria em energia
Auto manutenção celular
Se dispõe em
Converter nutrientes e moleculas
Síntese de degradação de Biomoléculas
Obtenção de energia química
Sintese de macro moléculas
Vias metabólicas
Caracteristicas específicas
Ocorre em lugares específicos
São reguladores irreversiíveis.
Reguladas também por
Ação de moléculas específicas
Disponibilidade de substrato ou de um metabolito
Enzimas regulatórias (Alostéricas)
As reações mais recorrentes são
Reação de oxiredução
Reaçõe s de transferencia
Reações de isomerização
Reações de formação
Reações de hidrolise
Reações de ligação (Ligases)
catabólicas
convergente:
quebram moléculas
anabólicas
divergentes: moléculas menores
para produzir maiores
Biossíntese
Tópico flutuante
Mapa conceitual Bioquímica Essencial