Topic flotante
Toma de muestras de laboratorio
SANGRE
Indicaciones
Prescripción de una o varias peticiones de extracción de sangre venosa por parte de un médico, con fines diagnósticos o terapéuticos.
Obtener una muestra de sangre venosa para análisis hematológico, bioquímico y/o microbiológico para el diagnóstico de enfermedades o como control de
salud.
SANGE ARTERIAL
La gasometría arterial (ABG, por sus siglas en inglés) mide la acidez ( pH ) y los niveles de oxígeno y dióxido de carbono en la sangre de una arteria. Esta prueba se utiliza para registrar lo bien que sus pulmones pueden trasladar el oxígeno a la sangre y eliminar el dióxido de carbono de la sangre.
1. Lavar y desinfectar las manos, ponerse guantes desechables. Limpiar y desinfectar la piel (igualmente que en la punción de la vena periférica. Se puede anestesiar con lidocaína al 1 %.
2. Sujetando la arteria entre las yemas de los dedos, insertar la aguja bajo el ángulo de 90° (en caso de la arteria radial puede ser de 45°).
3. Tras la aparición del flujo de sangre pulsátil en la jeringa, extraer ~1 ml de sangre, tirando delicada y lentamente del émbolo de la jeringa. Tener cuidado para no succionar aire a la jeringa. Después de extraer sangre, tapar la jeringa (o la aguja) con tapa y mezclar el contenido de la jeringa.
4. Presionar la arteria hasta que cese de sangrar: arteria radial durante ≥5 min, arterias femoral y braquial durante ≥10-15 min.
5- Se debe procesar la muestra en los siguientes 15 min. Si no es posible, se puede almacenar la sangre durante ≤1 h en la nevera a una temperatura ~4 °C y transportar en un recipiente con hielo.
Equipo
1. Aguja Ø 0,5-0,6 mm (25-23 G) para la punción de la arteria radial; Ø 0,6-0,7 mm (23-22 G) para la punción de la arteria femoral o braquial.
2. Jeringa especial heparinizada o jeringa de insulina cargada con heparina y luego vaciada (preferiblemente por la aguja que se utilizará para la punción).
3. Tapa para cerrar la jeringa (o la aguja) después de tomar la muestra.
4. Guantes, gasa, antiséptico, recipiente para agujas y jeringas usadas y opcionalmente equipo de anestesia para infiltración
Lugar de punción
Arteria braquial
En el pliegue del codo (lugar no recomendado por riesgo de hematoma, que a su vez puede comprimir el nervio; se prefiere la extremidad no dominante).
Arteria femoral
Por debajo del ligamento inguinal, generalmente en el pliegue inguinal (la arteria es lateral a la vena y medial al nervio).
Arteria radial
Cerca del área de flexión de la muñeca, entre el apéndice estiloides del húmero y el tendón del flexor radial de la mano (preferiblemente la extremidad no dominante). Antes de la punción y sobre todo antes de la cateterización de la arteria suele recomendarse la realización del test de Allen: pedir al paciente que apriete el puño durante 30 s, luego presionar con los dedos ambas arterias del antebrazo del paciente (la arteria cubital y la radial, mejor después de levantar la extremidad superior del paciente) y a continuación liberar la presión sobre la arteria cubital. Repetir el test liberando la presión sobre la arteria radial. El retorno capilar debe aparecer en unos 5 s. Si después de este tiempo la mano sigue pálida, el resultado del test es positivo (indica una alteración del suministro de sangre), en tal caso no se debe punzar la arteria de esta extremidad.
Preparación del paciente
Consentimiento informado del paciente. Posición supina. En el caso de que la punción se realice en arterias de una extremidad superior, la posición puede ser sentada.
SANGRE VENOSA
Catéter venoso central
1- Al extraer las muestras de sangre a través de un catéter de múltiples luces, utilizar la luz de mayor calibre si se conoce o utilizar la luz
distal.
2- Cerrar todas las infusiones durante un minuto antes de extraer las muestras de sangre.
3- Colocar la jeringa adecuada al volumen de desecho de cada catéter central, en la llave de 3 pasos más próxima.
4- Colocar el sistema de vacío (vacutainer) o jeringa adecuada al número y tipo de tubos necesarios.
5- Una vez extraída la sangre, lavar el catéter con 10 mL de suero fisiológico 0.9%.
6- Conectar un tapón estéril para la llave de tres pasos. 7- Anotar la técnica y determinaciones que se vayan a realizar de la
muestra extraída.
1. Explicación del procedimiento y su utilidad al paciente.
2. Preparación del personal.
Quién realice la técnica debe lavarse las manos y colocarse los guantes estériles (catéter venoso central) y no estériles (catéter arterial).
3. Realización de la técnica.
* Guantes estériles.
* Paño estéril.
* Jeringa de 10 ml.
* Jeringa de 20 ml.
* 20 ml Solución salina al 0,9%.
* Clorhexidina acuosa al 2% o alcohol al 70o
* Apósito estéril, preferentemente transparente semipermeable (no es necesario en catéteres tunelizados con zona de inserción cicatrizada (II)).
* Agujas Hubber o Glipper de diferente calibre (para reservorios subcutáneos).
* 5 ml de solución de heparina al 1% (100 IU/ml)
Catéter periférico
Técnica
1- Pinchar la piel y posteriormente la vena en dirección contraria al flujo sanguíneo, con un ángulo entre 15º y 30º respecto a la piel, con el bisel de la aguja hacia arriba 2- Soltar el compresor cuando refluya la sangre
y c onectar el frasco de hemocultivo al sistema de trasvase 3- Colocar la palomilla en la campana o adaptador de vacío
4- Conectar el sistema de trasvase al tubo para recoger la cantidad de sangre deseada 5- Inmediatamente después de su recogida, agitar suavemente 4-6 veces los tubos que contienen anticoagulante (especialmente EDTA y citrato de sodio). 6- Soltar el compresor antes de extraer la aguja de la vena, y aplicar un apósito sobre el punto de punción. Retirar la aguja suavemente y sin girarla.
7- Una vez retirada la aguja hacer o solicitar al paciente que realice una moderada presión sobre el apósito, manteniendo el brazo estirado, nunca doblado. Esta compresión se mantendrá durante unos 5 minutos, y unos 10 minutos en pacientes anticoagulados. En caso necesario poner una tira de esparadrapo. 8- Eliminar el material contaminado en recipientes adecuados, de acuerdo al
9- Protocolo de Gestión de Residuos Hospitalarios 10- No reencapuchar, doblar o romper las agujas utilizadas.
11- Comprobar el estado del paciente 12- Colocar al paciente en posición cómoda.
13- Retirarse los guantes y realizar la higiene de manos. 14- Enviar las muestras al laboratorio bien identificadas con los códigos correspondientes a la petición.
15- Anotar en los Registros de Enfermería: fecha de extracción y tipo de muestra.
Cuidados de enfermería
1- Preparar todo el material necesario.
2- Entrar en la habitación únicamente con los tubos necesarios para realizar esa
extracción teniendo la precaución de llevar tubos de repuesto.
3- Presentarse, confirmar la identidad del paciente utilizando al menos dos criterios, ninguno de los cuales será el número de la habitación, y explicar
el procedimiento solicitando su colaboración. Si es un niño pediremos la ayuda a otro profesional o a sus familiares. 4- Comprobar que se cumplen las condiciones necesarias antes de realizar la venopunción (ayunas, picos máximos y mínimos de fármacos, etc), así como de la condición física del paciente. Si el paciente no está en adecuadas condiciones físicas y/o psicológicas (ansiedad, agitación, etc.), inevitablemente se debe aplazar la extracción.
5- Colocar cómodamente al paciente (sentado o acostado) con el brazo extendido sobre una superficie plana, de manera que la mano esté más baja que el codo.
6- Seleccionar la vena teniendo en cuenta el estado de éstas, la cantidad de sangre necesaria y la edad del paciente. Las zonas de elección por orden decreciente son :
– Venas centrales del antebrazo (cefálica y mediana cubital).
– Vena basílica.
– Venas de la parte posterior del brazo.
– Venas de la muñeca y la mano.
– Venas de los pies.
– Yugular externa (en último recurso).
7- Si la muestra sanguínea debe ser tomada en miembros portadores de sistema de infusión, el sistema debe detenerse al menos durante 2 minutos, la punción se realizaría por debajo del punto de inserción del catéter destinado a infusión y
deberían retirarse un mínimo de 5 ml de sangre.
8- Palpar la vena para determinar la profundidad, calibre, elasticidad, etc
9- Desinfectar la zona con clorhexidina en solución acuosa o alcohólica al 2%, en solución alcohólica al 0,5% o alcohol de 70o con movimientos circulares,
comenzando en el punto de venopunción y hacia fuera. Dejar secar 2 minutos con clorhexidina en solución acuosa al 2%, y unos 30 segundos en el resto.
10- Realizar la higiene de las manos.
11- Colocarse los guantes limpios no estériles.
12- Colocar el compresor 8-10 cm por encima del lugar elegido. Se debe utilizar una presión suficiente para causar estasis venoso, pero no para causar dolor, malestar o molestias, ni dificultar o detener la circulación arterial (el pulso arterial debe permanecer palpable).
13- El compresor no debe mantenerse durante más de 1 minuto. Si se precisa más tiempo para realizar la extracción, el compresor debe ser retirado y vuelto a colocar tras 3 minutos.
14- No aplicar compresor en presencia de:
- Grandes venas visibles y palpables
– Para la determinación del pH venoso
15- A fin de facilitar la prominencia de las venas:
– Colocar un paño caliente en la zona de punción.
– Masajear la zona en dirección opuesta al flujo venoso.
– Aplicar agua caliente en la zona de punción.
– Evitar dar golpecitos en la zona
16- Etiquetar los tubos antes de la toma de muestras
Material
Preferentemente utilizar material de seguridad
* Extracción con tubo de vacío:
– Agujas estériles de doble bisel o palomilla del calibre adecuado
– Adaptador o campana
*Extracción con jeringa
– Agujas estériles o palomilla del calibre adecuado
– Jeringas * Compresor
* Contenedor de objetos punzantes
* Esparadrapo antialérgico
* Gasas o algodón
* Guantes limpios no estériles.
* Preparado de base alcohólica
* Clorhexidina en solución acuosa o alcohólica al 2%, en solución alcohólica al 0,5% o alcohol de 70o
* Tubos de vacío (tipo y cantidad adecuada según las pruebas solicitadas) * Microcontenedores para toma de muestra en niños.* Impreso de petición de analítica
* Etiquetas de identificación
* Gradilla
* Registros de enfermería
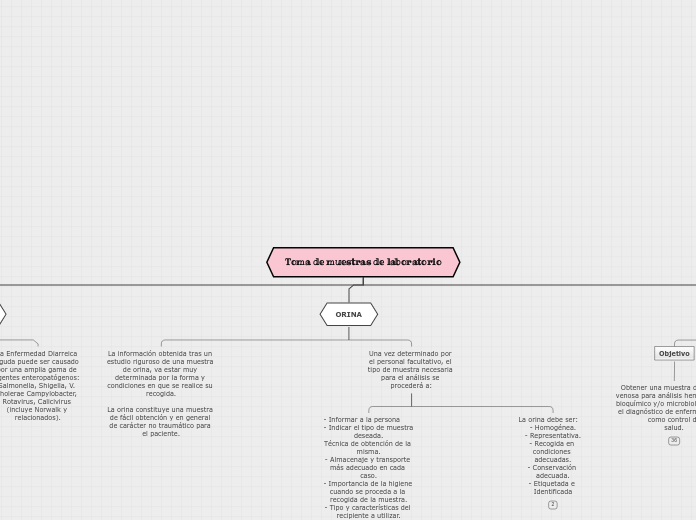
ORINA
Una vez determinado por el personal facultativo, el tipo de muestra necesaria para el análisis se procederá a:
La orina debe ser: - Homogénea.
- Representativa.
- Recogida en condiciones adecuadas.
- Conservación adecuada.
- Etiquetada e Identificada
Recipientes
- Limpios.
- Estériles.
- Envases de orina 24 h.
- Bolsas Pediátricas.
- Informar a la persona - Indicar el tipo de muestra deseada.
Técnica de obtención de la misma.
- Almacenaje y transporte más adecuado en cada caso.
- Importancia de la higiene cuando se proceda a la recogida de la muestra.
- Tipo y características del recipiente a utilizar.
PUNCIÓN SUPRAPÚBICA
- Técnica invasiva.
- Utilizada para el diagnóstico de infección en niños.
- Es la única muestra útil para el cultivo de anaerobios.
CATETERISMO VESICAL (SONDAJE)
- Técnica invasiva.
- Riesgo de infección urinaria.
- Facilita la toma de muestras para análisis bacteriológicos
- Análisis físico-químicos.
- Análisis bacteriológicos.
Algunas sustancias deben determinarse en un periodo de tiempo establecido. Tal es el caso de:
Sustancias cuya excreción varía en función de la dieta.
Compuestos que se excretan en función de la cantidad de hormonas presentes.
Sustancias cuya eliminación obedezca a ciclos metabólicos circadianos.
El tipo de muestra dependerá del análisis solicitado y estar directamente condicionado por dos importantes factores:
La interferencia de la contaminación en el análisis a realizar.
El tiempo.
MICCIÓN ESPONTÁNEA
Orina minutada
De 24 horas
Se recogen todas las micciones realizadas durante las 24 horas.
De 2 horas.
Fraccionada
Se recogen durante el día tres muestres a para determinar glucosuria y cetonuria.
Se utiliza en el seguimiento de pacientes diabéticos.
Orina tomada al azar
Características: Muestra al azar.
Indicaciones:
- Análisis rutinario.
- Determinación de la capacidad del riñón para concentrar la orina.
- Cultivos microbiológicos.
Primera orina de la mañana
Características: Muestra de 8 horas.
Indicaciones:
- Análisis rutinario de orina.
- Determinación de la capacidad de concentración del riñón.
- Estudios físico-químicos.
La información obtenida tras un estudio riguroso de una muestra de orina, va estar muy determinada por la forma y condiciones en que se realice su recogida.
La orina constituye una muestra de fácil obtención y en general de carácter no traumático para el paciente.
HECES
La Enfermedad Diarreica Aguda puede ser causado por una amplia gama de agentes enteropatógenos: Salmonella, Shigella, V. cholerae Campylobacter, Rotavirus, Calicivirus (incluye Norwalk y relacionados).
Dentro de la Vigilancia Epidemiológica de la enfermedad, la definición etiológica que realiza el laboratorio de microbiología contribuye a la
toma de decisiones oportunas para el control de la enfermedad.
Obtención de la muestra de heces
Recolección de la muestra
HISOPADOS RECTALES
No es necesario refrigerar los tubos con medio de transporte Cary Blair.
Las muestras para estudios de rotavirus no deberán colocarse en ningún momento en medio de transporte Cary Blair.
Para realizar la toma, se introduce el hisopo sobrepasando el esfínter
anal y se rota para hacer la toma de las criptas anales, mantener allí
durante 30 segundos para que se absorban los microorganismos y
retirar. Posteriormente se introduce en el medio de transporte, se cierra bien el tubo y se rotula con el nombre del paciente.
HISOPADOS FECALES
Romper la parte del mango que tocaron los dedos del recolector de muestra (para evitar fuentes de contaminación externa). Cerrar bien el tubo y rotularlo con el nombre del paciente.
Este procedimiento se puede realizar también por el personal del laboratorio, cuando la muestra ha llegado a la sección de microbiología y si muestra va a ser enviada para su proceso al laboratorio de referencia.
Una vez recogidas las heces del paciente, se impregnarán dos hisopos estériles, con las heces depositadas en los recipientes limpios.
Posteriormente se introducen los hisopos, cada uno en el medio de transporte Cary Blair, cuidando de que la punta del hisopo quede 2 cm. por debajo de la superficie y sin perforar el fondo del medio de transporte.
Envasado de la muestra en frasco
Envío al Laboratorio. y anexar solicitud de laboratorio, adecuadamente requisitada.
En el caso de que se sospeche de infección por Rotavirus, la muestra podrá conservarse a temperatura ambiente hasta por 4 horas. Sin embargo, se
sugiere mantener en red fría entre 2°C y 8°C hasta su envío y llegada al laboratorio de referencia. Puede conservarse por un periodo de no más de 7 días en refrigeración.
Colocar la(s) muestra(s) en una funda plástica y cerrarla evitando que se derrame y se mezcle con otras muestras.
Introducirlas en el frasco estéril con la ayuda de una espátula o
abatelenguas desechable.
Recolectar de 5 a 10 ml de heces si son líquidas, o de 5-10 g si tienen consistencia pastosa.
Rotular el frasco colocando el nombre del paciente, edad y fecha de recolección
Objetivo
Es necesario obtener una muestra de heces de todos los casos de Enfermedad Diarreica Aguda (EDA), que son atendidos en las unidades médicas, con el objetivo de contribuir a mejorar el proceso diagnóstico y manejo específico.
En pacientes adultos, se debe asegurar que la persona defeque en un recipiente limpio, cuidando que la muestra no se mezcle con orina. En los pacientes menores de un año de edad, se puede estimular el esfínter anal con un hisopo estéril y esperar a que se produzca la deposición en un pañal desechable, que se sugiere colocar al revés para que no se absorba la muestra. (Colocar la parte no absorbente en contacto con el paciente).
Características del material para toma de muestras de materia fecal
Medios de
transporte para
heces (Cary-Blair)
Tubo con medio de
transporte e hisopo
Tiempo de proceso:Considerar como máximo 24 hrs. para su envío al
laboratorio de referencia
Observaciones: - Se solicita al Servicio de Epidemiología.
- Diagnóstico de bacterias enteropatógenas.
- No requiere refrigeración.
Frasco estéril
Boca ancha de
plástico de 50 ml.
estéril con tapa de
rosca, y cierre
hermético
Tiempo de proceso: Para envío inmediato al laboratorio de
referencia
Observaciones: - Para envío de la muestra de
heces al laboratorio de referencia.
- Diagnóstico de bacterias enteropatógenas y Rotavirus
Frasco no estéril
Boca ancha, limpio y
cierre hermético
Tiempo de proceso: Máximo 2 hrs. en la misma unidad médica.
Observaciones: No contendrá restos de jabones, detergentes, desinfectantes o iones metálicos.