Reacciones Quimicas
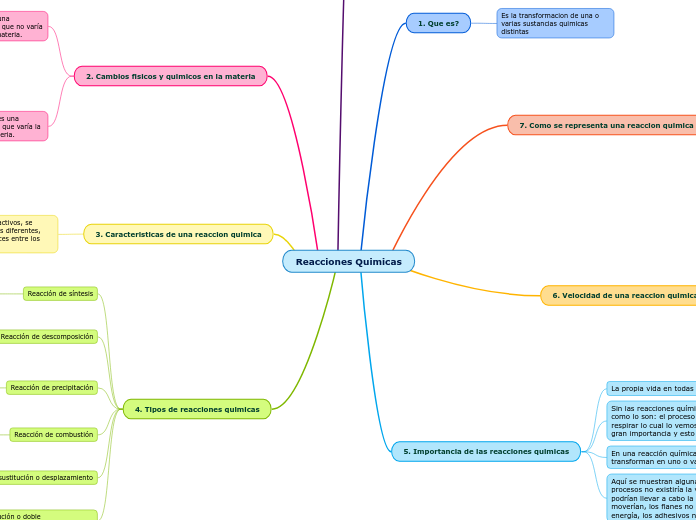
4. Tipos de reacciones quimicas
Reacción de doble sustitución o doble desplazamiento
En este tipo de reacción existe un intercambio de elementos de dos o más compuestos.
Ejemplo: La reacción en que se forma cloruro de sodio.
HCl\ +\ NaOH\ \rightarrow\ NaCl\ + \ H_{2}O
Reacción de sustitución o desplazamiento
En este tipo de reacción un elemento desplaza a otro dentro de un compuesto químico.
Ejemplo: La reacción entre el Zinc y Sulfato de Cobre.
Zn\ +\ CuSO_{4} \rightarrow\ Cu\ +\ ZnSO_{4}
Reacción de combustión
En este tipo de reacción los reactivos son un combustible y el oxígeno del aire, y los productos generados son dióxidos de carbono y agua.
Ejemplo: La combustión del Metano.
CH_{4}\ +\ 2\ O_{2}\ \rightarrow\ CO_{2}\ +\ 2\ H_{2}O
Reacción de precipitación
En este tipo de reacción que ocurre en un medio acuoso, en la que uno de los productos es una sustancia poco soluble y se deposita en forma sólida (precipita).
Ejemplo: Reacción entre el yoduro de potasio y el nitrato de plomo (II)
2\ KI\ +\ Pb(NO_{3})_{2}\ \rightarrow\ 2\ KNO_{3} + PbI_{2}
Reacción de descomposición
En este tipo de reacción una sustancia o compuesto se descomponen para formar dos o más productos.
Ejemplo: Descomposición del clorato de potasio en cloruro de potasio y oxígeno.
2\ KClO_{3}\ \rightarrow\ 2\ KCl\ +\ 3\ O_{2}
Reacción de síntesis
En este tipo de reacción dos o más compuestos reaccionan entre sí para formar un nuevo producto.
Ejemplo: Reacción para formar Amoniaco (NH3).
N_{2}\ +\ 3H_{2}\ \rightarrow\ 2NH_{3}
3. Caracteristicas de una reaccion quimica
Proceso por el cual una o más sustancias, llamadas reactivos, se transforman en otra u otras sustancias con propiedades diferentes, llamadas productos. En una reacción química, los enlaces entre los átomos que forman los reactivos se rompen.
Reaccion endotermica: Se absorbe energia durante del curso de la reaccion.
Reaccion exotermica: Se desprende energia en el curso de la reaccion.
2. Cambios fisicos y quimicos en la materia
Un cambio quimico es una transformación en la que varía la naturaleza de la materia.
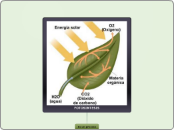
Las combustiones son cambios químico
5. La reaccion del oxido de calcio con agua.
4. Reaccion de los acidos con los carbonatos.
3. La reaccion del bicarbonato con vinagre.
2. Carne quemada.
1. Clavo de hierro en acido.
Un cambio fisico es una transformación en la que no varía la naturaleza de la materia.
Los cambios de estado son cambios físicos
Ejemplos:
5. Disoluciones de solidos en liquidos.
4. Magnetizacion de metales.
3. Solidificacion de liquidos.
2. Condensacion de gases.
1. Evaporacion de liquidos.
Topic principal
5. Importancia de las reacciones quimicas
Aquí se muestran algunas reacciones químicas comunes. Sin estos procesos no existiría la vida tal como la conocemos: las plantas no podrían llevar a cabo la fotosíntesis, los automóviles no se moverían, los flanes no cuajarían, los músculos no podrían quemar energía, los adhesivos no pegarían y el fuego no ardería.
En una reacción química, uno o más tipos de materia se transforman en uno o varios tipos distintos de materia.
Sin las reacciones químicas no podríamos hacer tareas tan sencillas como lo son: el proceso de digestión o simplemente el poder respirar lo cual lo vemos como una tarea sencilla pero tiene una gran importancia y esto es resultado un proceso químico.
La propia vida en todas sus expresiones.
6. Velocidad de una reaccion quimica
Las concentraciones de las especies reactivas.
Catalizadores.
Temperatura.
La naturaleza de Reactivos y Productos.
cantidad de sustancia que se transforma en una determinada reacción por unidad de volumen y tiempo.
Relaciona el cambio en la concentración de reactivos o productos con el tiempo y se expresa, usualmente, en mol/l × s. su velocidad se establece midiendo la variación de la concentración de los reactivos o de los productos con el tiempo.
7. Como se representa una reaccion quimica
Se representa mediante una ecuacion quimica en la cual se puede identificar:
Productos.
Condiciones.
(S) Solido.
Sustancias.
Reactivos.
Compuesto.
Quimico.
1. Que es?
Es la transformacion de una o varias sustancias quimicas distintas