Teoría de Enlaces
What's your essay about?
Type in the title of your essay.
Enlace Químico
Analyze another essay written on this topic
Find at least one example and see whether it is well written or not.
Los átomos no se encuentran aislados en la naturaleza, sino que están agrupados y formados por una infinidad de moléculas, y estas infinidades forman las sustancias. Estas agrupaciones de átomos y involucran las uniones y por lo tanto la actividad química. La actividad química de los átomos y habitan en los electrones, específicamente en los electrones de valencia, aquellos que están localizados en la última capa o nivel de energía de un átomo.
Type in the title and the author(s)
of the essay which you're going to analyze.
Fuerzas dipolo instantáneo
Las fuerzas de dispersión son fuerzas atractivas débiles que se establecen fundamentalmente entre sustancias no polares, aunque también están presentes en las sustancias polares. Se deben a las irregularidades que se producen en la nube electrónica de los átomos de las moléculas por efecto de la proximidad mutua.
Fuerzas dipolo inducido
Tienen lugar entre una molécula polar y una molécula apolar. En este caso, la carga de una molécula polar provoca una distorsión en la nube electrónica de la molécula apolar y la convierte, de modo transitorio, en un dipolo.
Puentes de hidrógeno
Los puentes de hidrógeno constituyen un caso especial de interacción dipolo-dipolo (Figura de la derecha). Se producen cuando un átomo de hidrógeno está unido covalentemente a un elemento que sea muy electronegativo y con dobletes electrónicos sin compartir de muy pequeño tamaño y capaz, por tanto, de aproximarse al núcleo del hidrógeno
Fuerzas hidrofóbicas
En un medio acuoso, las moléculas hidrofóbicas tienden a asociarse por el simple hecho de que evitan interaccionar con el agua. Lo hace por razones termodinámicas: las moléculas hidrofóbicas se asocian para minimizar el número de moléculas de agua que puedan estar en contacto con las moléculas hidrofóbicas.
Ion dipolo inducido
Tienen lugar entre un ion y una molécula apolar. La proximidad del ion provoca una distorsión en la nube electrónica de la molécula apolar que convierte (de modo transitorio) en una molécula polarizada. En este momento se produce una atracción entre el ion y la molécula polarizada.
Ion Dipolo
Por ejemplo, el NaCl se disuelve en agua por la atracción que existe entre los iones Na+ y Cl- y los correspondientes polos con carga opuesta de la molécula de agua. Esta solvatación de los iones es capaz de vencer las fuerzas que los mantienen juntos en el estado sólido.
Son las fuerzas que se establecen entre un ion y una molécula polar.
Enlaces Metálicos
Este tipo de enlace metálico solo se ejecuta entre los átomos de metales, bien entre átomos de un mismo metal o entre átomos de metales diferentes (aleaciones).
Covalente Dativo
En varios casos para expresar el porque en una molécula se cumple la regla del octeto, es fundamental que uno de los átomos que opera en el enlace donde el par de electrones de enlace y reacomode los electrones de valencia para que así cumplan con la regla.
Covalente Polar
El covalente polar tiene la electronegatividad que ayuda a moverse al electrón del elemento menos electronegativo hacia el más electronegativo, pero no hay ganancia y perdida de electrones, pero los átomos se cargan con cierta polaridad por el desplazamiento de los electrones. Podemos decir que un enlace es covalente polar cuando la diferencia de sus valores de electronegatividad es menor a 1,5 se conceptúa un enlace de este tipo.
Covalente Apolar
Is the logical sequence of the essay accurate or faulty?
Select an option:
AccurateFaulty
Los electrones de valencia de dos no metales se atraen mediante a que presentan espín contrario, esto presenta compartición de dos electrones, al ser dos átomos del mismo elemento se deshacen la electronegatividad, aquí no se forma iones, y se clasifica en simple si es un par de electrones compartidos
Enlace Covalente
Es la unión de átomos no-metales para compartir sus electrones de valencia, mediante las fuerzas de atracción electromagnéticas, principalmente; aquí los átomos no ganan ni pierden sus electrones, lo cual comparten en cantidades de uno, dos, tres pares y hasta cuatro en varias situaciones.
What evidence do(es) the author(s) present?
Type in the evidence.
Add notes if you need larger blocks of text.
Enlace Iónicos
El enlace iónico es conocido como enlace electro Valente, teniendo en la última palabra de electrovalencia, que es la capacidad de un átomo para ganar o perder electrones de valencia en un enlace iónico, generando así los estados de oxidación.
What claims do(es) the author(s) make?
Type them in.
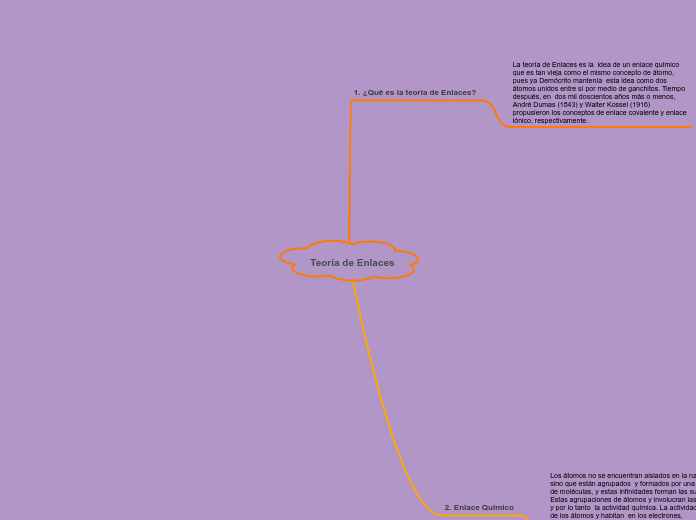
¿Qué es la teoría de Enlaces?
Research your topic
Write down the sources you will base your essay on.
La teoría de Enlaces es la idea de un enlace químico que es tan vieja como el mismo concepto de átomo, pues ya Demócrito mantenía esta idea como dos átomos unidos entre sí por medio de ganchitos. Tiempo después, en dos mil doscientos años más o menos, André Dumas (1843) y Walter Kossel (1916) propusieron los conceptos de enlace covalente y enlace iónico, respectivamente.