によって Camilla Bertoldo 2か月前.
63
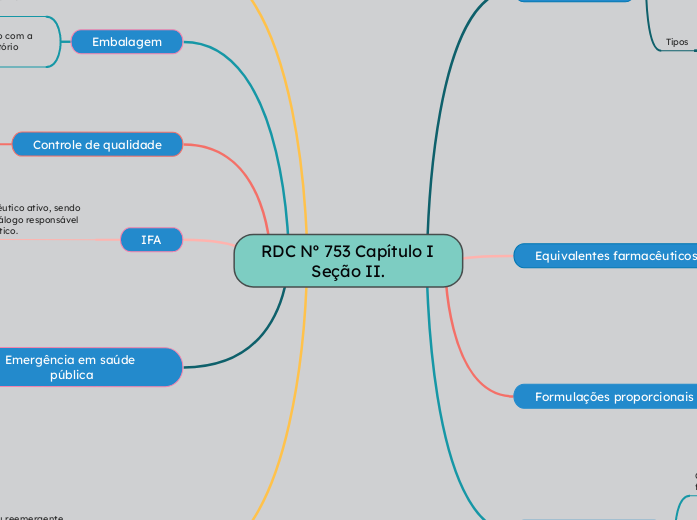
RDC Nº 753 Capítulo I Seção II.
A produção de medicamentos envolve o uso de matérias-primas ativas e inativas, que podem ser alteradas ou inalteradas. Medicamentos devem ter equivalência farmacêutica, o que significa que eles podem ter os mesmos excipientes, via de administração, princípio ativo, forma farmacêutica e quantidade do princípio ativo.