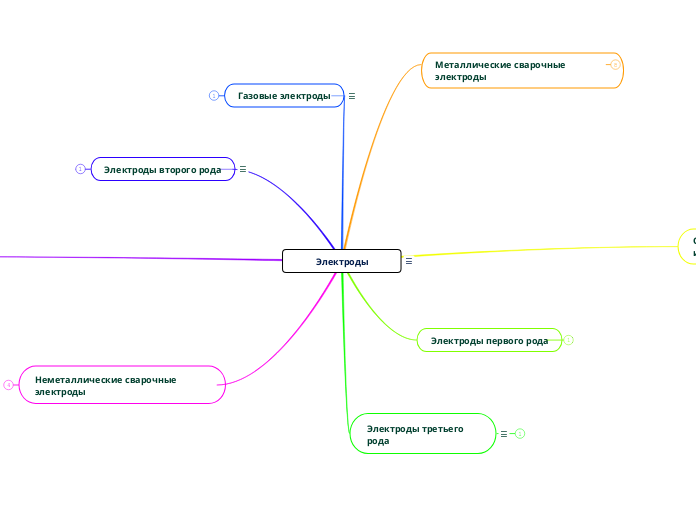
Электроды
Сварочные электроды являются основным расходным материалом для электродуговой сварки. Их выпускается огромное количество марок для самых разнообразных целей.
Электроды третьего рода
Теоретический интерес представляют электроды третьего рода, где металл находится в контакте с двумя труднорастворимыми солями. В качестве примера электрода третьего рода рассмотрим систему Pb2+PbCl2AgClAg , в которой идет электрохимический процесс
2AgCl + Pb2+ + 2e = 2Ag + PbCl2 .
Как видно, при работе электрохимической цепи происходит превращение менее растворимой соли в более растворимую (
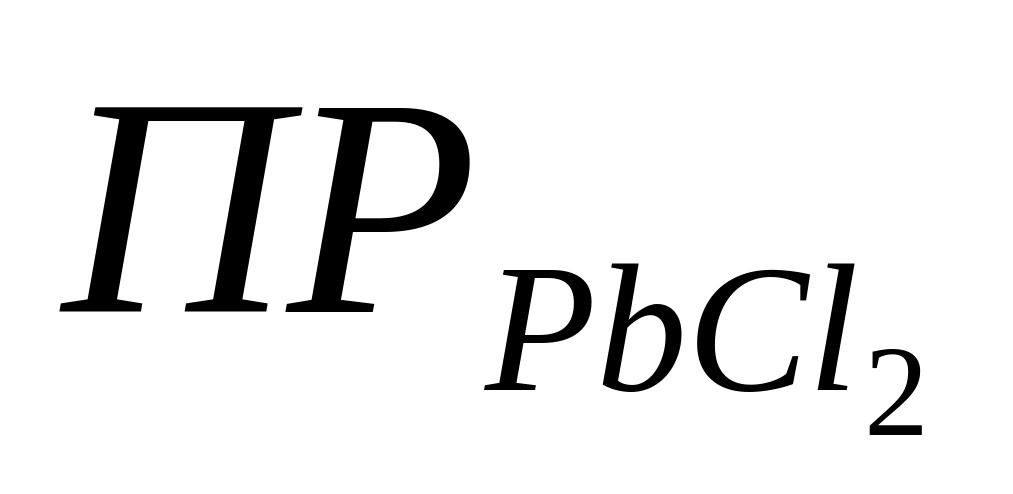 ). В этой системе потенциал серебра определяется активностью ионов Ag+, активность ионов Ag+ – произведением растворимости и активностью ионов Cl– , а активность ионов Cl– – произведением растворимости и активностью ионов Pb2+ . Таким образом,
). В этой системе потенциал серебра определяется активностью ионов Ag+, активность ионов Ag+ – произведением растворимости и активностью ионов Cl– , а активность ионов Cl– – произведением растворимости и активностью ионов Pb2+ . Таким образом,

 .
.
Другой пример электрода третьего рода, который ранее использовался для потенциометрического определения катионов Са2+ , – это свинцовый электрод, покрытый слоями труднорастворимых оксалатов свинца и кальция и погруженный в раствор соли кальция.
металл находится в контакте с двумя труднорастворимыми солями
Электроды первого рода
К электродам первого родаотносят металлические электроды, обратимые относительно катионов, и металлоидные, обратимые относительно анионов. Обратимость электрода относительно тех или других ионов означает зависимость его потенциала от концентрации (активности) потенциалопределяющих ионов.
Примерами электродов первого рода являются системы, представляющие собой металлы, погруженные в растворы своих солей Мz+│М(обратимые к катиону), и металлоидыМеz-│Ме(обратимые к аниону).
металлические электроды
Окислительно-восстановительные, или редокси-электроды
Окислительно-восстановительные, или редокси-электроды.
Любая электродная реакция связана с изменением окислительно-восстановительного состояния участвующих в ней веществ, и в этом смысле все электроды представляют собой редокси-системы. Однако термин окислительно-восстановительные, или редокси-электроды, употребляется обычно в тех случаях, когда в реакции не участвуют непосредственно металлы или газы. Металл в редокси-электроде, обмениваясь электронами с участниками окислительно-восстановительной реакции, принимает потенциал, отвечающий установившемуся редокси-равновесию. К металлическому проводнику предъявляются здесь те же требования, что и в случае газовых электродов.
Следует различать простые и сложные редокси-электроды. В первом случае электродная реакция сводится к перемене валентности ионов без изменения их состава, например
Fe3+ + e = Fe2+ ,
Tl3+ + 2e = Tl+ ,
MnO4– + e = MnO42– ,
Fe (CN)63– + e = Fe (CN)64– .
Если обозначить окисленные ионы Ox, а восстановленные Red, то все написанные выше реакции можно выразить одним общим уравнением
Ox + ne = Red .
Простой редокси-электрод записывается в виде схемы
Red, Ox Pt ,
а его потенциал дается уравнением
ERed,Ox = EoRed,Ox + 2,303 lg 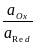 .
.
Как видно, потенциал простого редокси-электрода определяется отношением активностей ионов в двух различных степенях окисления. Если элемент образует ионы нескольких валентностей, то ему будет отвечать столько редокси-электродов, сколько можно получить попарных сочетаний (три валентности три различных редокси-электрода).
Потенциалы простых редокси-электродов можно легко связать с потенциалами соответствующих электродов первого рода. Пусть, например, металл М способен существовать в растворе в виде ионов высшей валентности Мh и низшей валентности Mn. Для него возможны два электрода первого рода Mh M и Mn M и один редокси-электрод Mn, Mh M , стандартные потенциалы которых соответственно равны 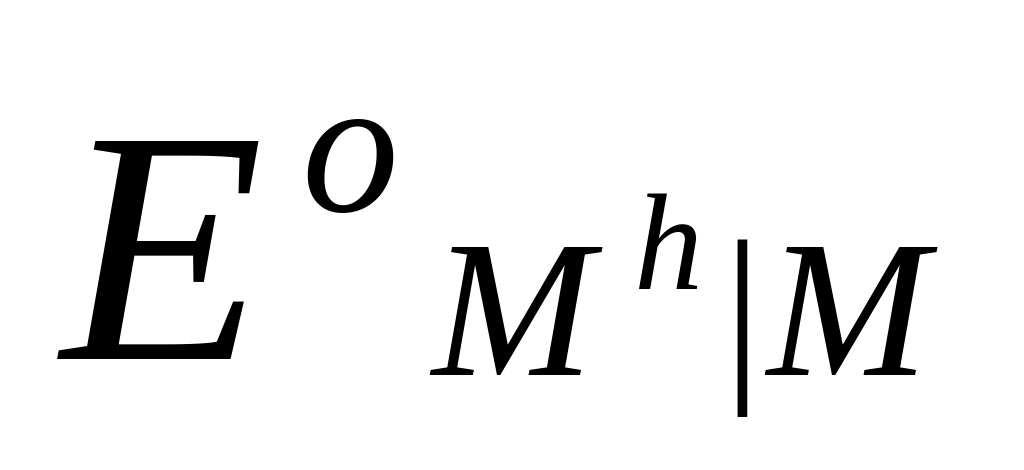 ,
, 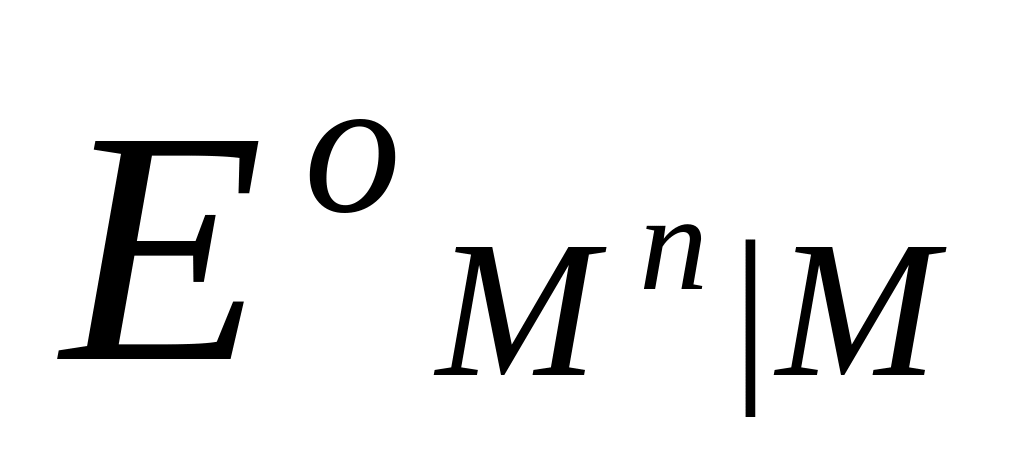 и
и 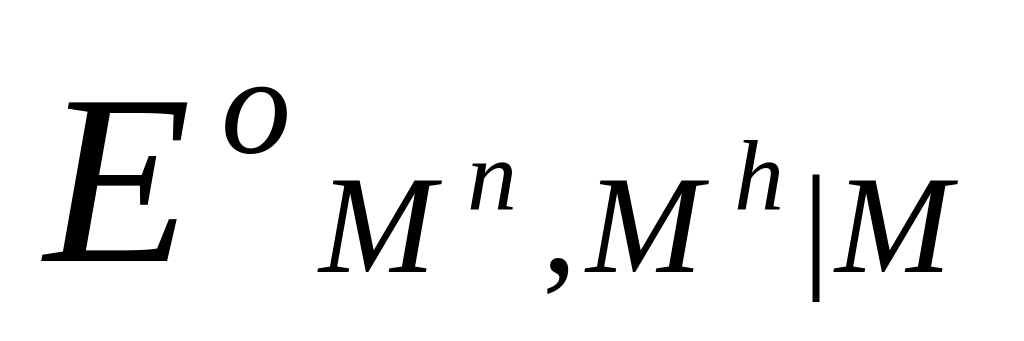 . Связь между этими величинами можно найти, проведя мысленно процесс электрохимического растворения металла М с получением ионов высшей валентности Mh либо непосредственно, либо через промежуточное образование ионов низшей валентности Mn. Предполагается, что процесс растворения протекает обратимо и изотермически в бесконечно большом объеме раствора, в котором активности ионов каждого сорта равны 1. Этот процесс можно представить в виде следующего простого цикла:
. Связь между этими величинами можно найти, проведя мысленно процесс электрохимического растворения металла М с получением ионов высшей валентности Mh либо непосредственно, либо через промежуточное образование ионов низшей валентности Mn. Предполагается, что процесс растворения протекает обратимо и изотермически в бесконечно большом объеме раствора, в котором активности ионов каждого сорта равны 1. Этот процесс можно представить в виде следующего простого цикла:
hFEoh
M Mh
nFEon (hn)FEon,h
Mn
Из цикла следует: hEoh = nEon + (h n)Eon,h .
Это уравнение известно как правило Лютера; по нему можно рассчитать стандартный потенциал любого из трех электродов, если известны значения стандартных потенциалов двух других электродов. Уравнение применяется в тех случаях, когда непосредственное определение одного из потенциалов или затруднительно, или невозможно. Так, например, потенциал электрода первого рода Fe3+ | Fe , измерить который непосредственно не удается из-за неустойчивости в этих условиях ионов Fe3+, можно найти из доступных прямому измерению стандартных потенциалов электрода первого рода Fe2+ | Fe и простого редокси-электрода Fe2+, Fe3+| Fe:
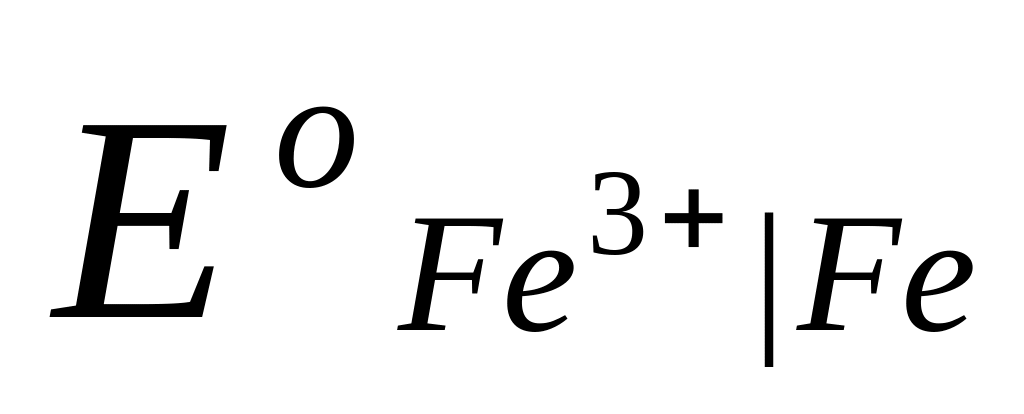 =
= 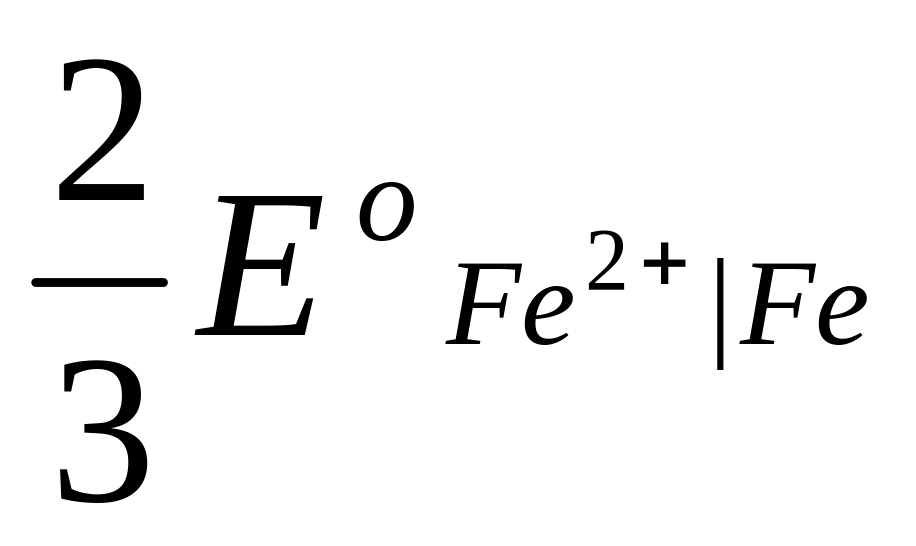 +
+ 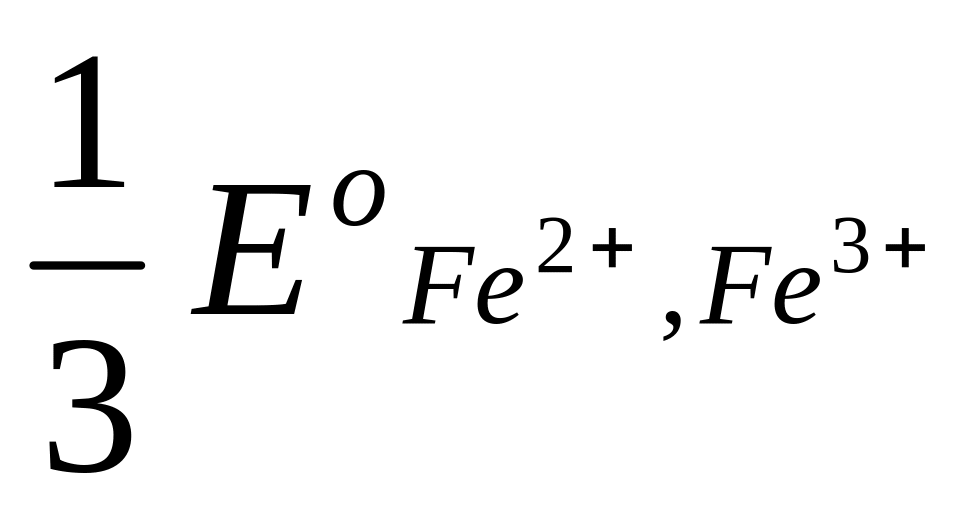 .
.
В сложных редокси-электродах реакция протекает с изменением валентности реагирующих частиц и их состава. В реакциях такого рода участвуют обычно ионы водорода и молекулы воды; участие молекул воды не сказывается на характере уравнений для электродного потенциала, так как активность воды в ходе реакции (за исключением очень концентрированных растворов) остается постоянной. Схему сложного редокси-электрода можно записать следующим образом:
Red, Ox, H+ | Pt .
Таким образом, потенциал сложного редокси-электрода является функцией не только активностей окисленных и восстановленных частиц, но и активности водородных ионов. Например, для системы MnO4– Mn2+, в которой протекает электродная реакция
MnO4– + 8H+ + 5e = Mn2+ + 4H2O ,
потенциал электрода передается уравнением
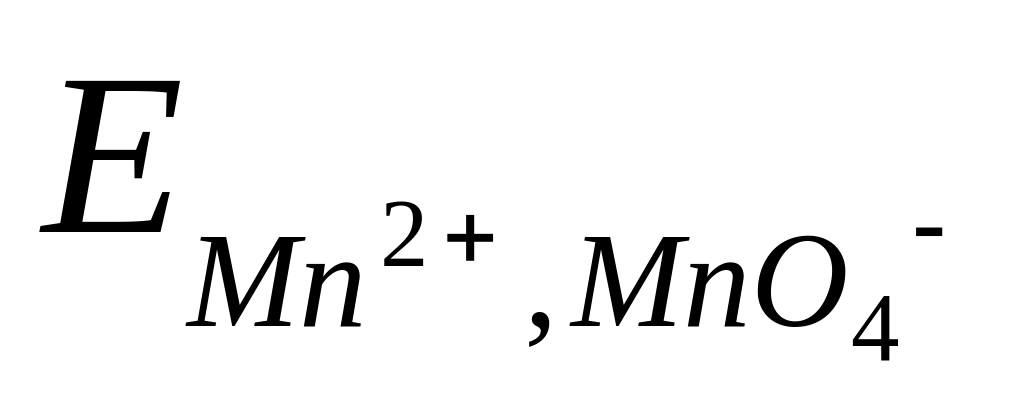 =
= 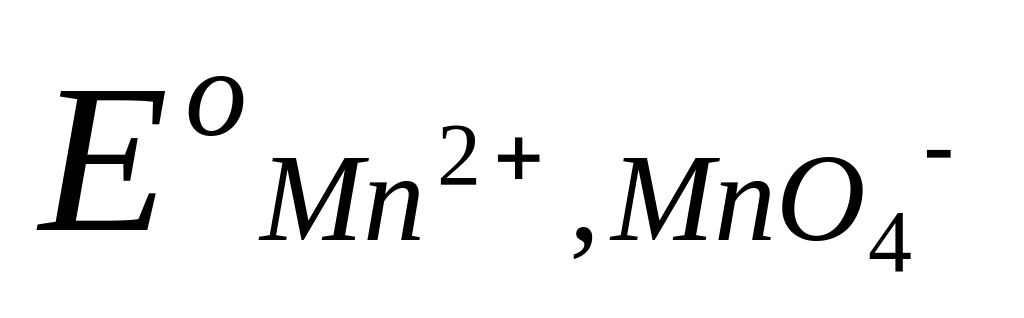 +
+ 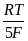 ln
ln 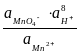 =
=
= 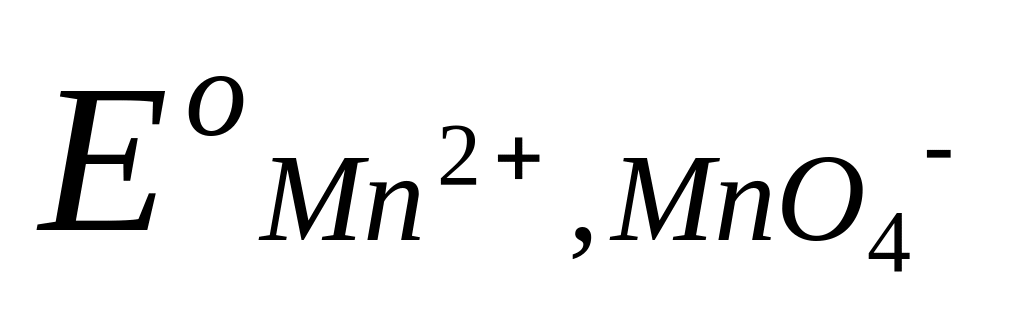 + 2,303 lg
+ 2,303 lg 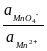 + 2,303
+ 2,303  lg .
lg .
Сложные редокси-электроды можно использовать как индикаторные электроды при измерении рН. Для этой цели часто применяют электрод, обратимый по отношению к системе хинон-гидрохинон. Для системы хинон-гидрохинон (х, гх) с реакцией
С6Н4О2 + 2Н+ + 2е = С6Н4(ОН)2
потенциалу электрода отвечает уравнение
Eх, гх = Eох, гх + 2,303 lg 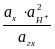 = Eох, гх + 2,303 lg
= Eох, гх + 2,303 lg 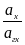 +
+
+ 2,303 lg .
В раствор, рН которого хотят измерить, вводят эквимолярную смесь хинона и гидрохинона. Если считать, что отношение концентраций равно отношению активностей
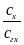 =
= 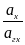 = 1 ,
= 1 ,
то уравнение упрощается до
Eх, гх = Eох, гх + 2,303 lg = Eох, гх 2,303 рН
и потенциал такого электрода, обычно называемого хингидронным, будет определяться непосредственно значением рН раствора. При 25оС Eох, гх = 0,6992 В; температурная зависимость Eох, гх хорошо изучена. Хингидронный электрод легко приготовляется и удобен в работе. Хингидронным электродом нельзя пользоваться в щелочных растворах (гидрохинон слабая кислота, в щелочной среде он сильно диссоциирует и концентрация его в насыщенном растворе не является постоянной), а также в присутствии сильных окислителей или восстановителей.
Лекция 9
Классификация электрохимических цепей. Физические цепи. Концентрационные цепи. Химические цепи. Аккумуляторы
Учитывая природу электродной реакции, можно классифицировать не только различные типы электродов, но и их комбинации. Электрохимические цепи обычно классифицируют по двум признакам: по источнику электрической энергии (физические, концентрационные, химические) и по наличию или отсутствию в цепи границы двух различных растворов (цепи с переносом и без переноса).
1. Система составлена из двух химически одинаковых электродов, на которых совершается одна и та же электродная реакция. ЭДС таких систем была бы равна нулю, если бы физические свойства электродов, а следовательно, и их стандартные потенциалы были одинаковыми. Электрохимические системы, в которых электроды отличаются только физическими свойствами, называются физическими цепями. Как правило, один из двух электродов физической цепи находится в более устойчивом, а другой в менее устойчивом при данных условиях состоянии. Источником электрической энергии в физических цепях служит свободная энергия перехода электрода из менее устойчивого в более устойчивое состояние.
- Два электрода совпадают по своим физическим свойствам, качественному химическому составу и природе электродной реакции. Они отличаются лишь тем, что активность одного или нескольких участников реакции на электродах неодинакова. Электрохимические цепи, в которых электроды отличаются только активностью (концентрацией) участников электродной реакции, называются концентрационными цепями. Источником электрической энергии в концентрационных цепях служит энергия переноса вещества от большей активности к меньшей.
- Два электрода могут отличаться и по химическим, и по физическим свойствам. Такие цепи называются химическими. В химических цепях источником электрической энергии служат протекающие в них химические реакции.
- Два электрода могут отличаться и по химическим, и по физическим свойствам. Такие цепи называются химическими. В химических цепях источником электрической энергии служат протекающие в них химические реакции.
Металлические сварочные электроды
Плавящиеся
Бронзовые и др.
Электроды из бронзы - материалы, которые нужны для дуговой сплавки изделий из бронзы и других цветных металлов.
Бронзовые элементы активно эксплуатируются в промышленной сфере в ручной сварке. При стыковке труб, различных соединений, где важна достаточная герметизация и долговечность.
Алюминиевые
Чистый алюминий и сплавы на его основе используются практически во всех отраслях промышленности и занимают второе место по объемам производства после железа.
Условия и особенности процесса сварки алюминия
Сварка алюминия имеет ряд особенностей, обусловленных свойствами материала:
- Температура плавления алюминия составляет всего 657°C, а теплопроводность в 3 раза превышает аналогичный показатель углеродистой стали. При нагреве алюминий и его сплавы становятся хрупкими и требуют аккуратного обращения в процессе проведения сварочных работ.
- На поверхности алюминия образуется окисел Al2O3 с температурой плавления 2050°C, затрудняющий проведение сварки и загрязняющий сварной шов. Удаление пленки производится посредством катодного распыления при электродуговой сварке или растворения криолитом (N3AlP6).
- Не более чем за 2-3 часа до проведения работ необходимо тщательно зачистить места сварки от окислов, шлаков и загрязнений при помощи металлической щетки или шабера.
- Сварочные работы проводятся в среде инертного газа. Может использоваться подача баллонного газа или флюсы, выделяющие газ в процессе разложения.
Медные
 Электроды медные сварочные применяются для ручной дуговой сварки инвертором (ММА) меди и ее сплавов. Работа ведется на постоянном токе с короткой дугой. При большой толщине деталей необходим предварительный подогрев, содействующий лучшему качеству шва.
Электроды медные сварочные применяются для ручной дуговой сварки инвертором (ММА) меди и ее сплавов. Работа ведется на постоянном токе с короткой дугой. При большой толщине деталей необходим предварительный подогрев, содействующий лучшему качеству шва.
Чугунные
 ЦЧ-4. В основном применяются для ремонтной наплавки на чугунные детали и для исправления дефектов в отливках – пор, раковин, недоливов, трещин и т. д. Часто ими наплавляют только первые 1–2 слоя, далее наплавка продолжается электродами других марок, что дает более эффективный результат. Кроме того, эта марка используется для сварки деталей из чугуна и нержавеющих сталей, варить можно с предварительным подогревом и без него.ОЗЧ-4. Используются для холодной сварки и наплавки. Стержни имеют никелевую основу. Для марки характерна низкая проплавляющая способность. Использовать электроды рекомендуется для наплавки завершающих слоев – металл шва получает повышенную ударную вязкость и стойкость к истиранию. Присадочный материал наплавляется на постоянном токе обратной полярности в вертикальном и нижнем положении.
ЦЧ-4. В основном применяются для ремонтной наплавки на чугунные детали и для исправления дефектов в отливках – пор, раковин, недоливов, трещин и т. д. Часто ими наплавляют только первые 1–2 слоя, далее наплавка продолжается электродами других марок, что дает более эффективный результат. Кроме того, эта марка используется для сварки деталей из чугуна и нержавеющих сталей, варить можно с предварительным подогревом и без него.ОЗЧ-4. Используются для холодной сварки и наплавки. Стержни имеют никелевую основу. Для марки характерна низкая проплавляющая способность. Использовать электроды рекомендуется для наплавки завершающих слоев – металл шва получает повышенную ударную вязкость и стойкость к истиранию. Присадочный материал наплавляется на постоянном токе обратной полярности в вертикальном и нижнем положении.
МНЧ-2. Наиболее универсальная марка при работе с чугунами любого типа. Позволяет варить детали без предварительной прокалки. Основа состава стержня – никель и медь. Сварка и наплавка выполняются холодным способом, ток – постоянный обратной полярности. Детали свариваются короткими (до 3 см) валиками, с последующим охлаждением и проковкой каждого валика. Электроды рекомендуются в случаях, когда необходимо получить металл шва с высокой чистотой поверхности после механической обработки, а также когда нужен корневой шов повышенной плотности.
ОЗЖН-1. Используются для холодной сварки серого и высокопрочного чугуна. Химическую основу сердцевины составляют никель и железо. Покрытие – основное. В ряду особенностей: цвет металла сварного шва практически неотличим от основного металла.
ОЗЧ-2. Это медные электроды для сварки чугуна (Cu – основа, Fe – 10%, Ni – 2%). В отличие от указанных выше марок с обмазкой основного типа они имеют кислое покрытие. Предназначены для холодной сварки, заварки дефектов литья и наплавки, но работать можно лишь с серым и ковким чугуном. Как и МНЧ-2, позволяют получить сварной шов с повышенными требованиями по плотности. Рекомендуются при заварке крупных дефектов литья. В комбинации с электродами МНЧ-2, ОЗЧ-3 и ОЗЖН-1 отлично подходят для многослойной наплавки: стержнями первых двух марок наплавляются первый и последний слои, а электродами ОЗЧ-2 и ОЗЖН-1 поочередно – средние.
ОЗЧ-6. Также электроды с медной основой, но в отличие от ОЗЧ-2 имеют основное покрытие. Позволяют работать с серыми и ковким чугуном, наиболее подходят для сварки тонкостенных деталей. Хорошо зарекомендовали себя при заварке навесу сквозных дефектов литья и при работе даже с «горелым» чугуном – деталями с низкой нагрузкой. Перед сваркой не требуется предварительного прогревания заготовки.
Стальные
Стальной покрытый электрод представляет собой определенных размеров стержень, на поверхность которого опрессовкой или окунанием нанесено специальное покрытие.
Неплавящиеся
Вольфрамовые электроды
 Неплавящиеся электроды изготовленные из вольфрама в основном применяются для аргонодуговой сварки. Могут состоять полностью из вольфрама, а также содержать смеси. Имеют повышенную износостойкость. Вольфрамовые электроды из чистого вольфрама обычно используют для сварки на переменном токе, а электроды с активирующими добавками для сварки на переменном и постоянном токе прямой и обратной полярности.
Неплавящиеся электроды изготовленные из вольфрама в основном применяются для аргонодуговой сварки. Могут состоять полностью из вольфрама, а также содержать смеси. Имеют повышенную износостойкость. Вольфрамовые электроды из чистого вольфрама обычно используют для сварки на переменном токе, а электроды с активирующими добавками для сварки на переменном и постоянном токе прямой и обратной полярности.
Неметаллические сварочные электроды
Амальгамные электроды
Амальгамные электроды
Это полуэлементы, в которых амальгама какого-либо металла находится в контакте с раствором, содержащим ионы этого металла:
Мn+ Mm , Hg , mMn+ + mne Mm (Hg) .
Ртуть ведет себя как инертная среда, в которой растворен металл, а потенциалоопределяющими являются ионы этого металла:
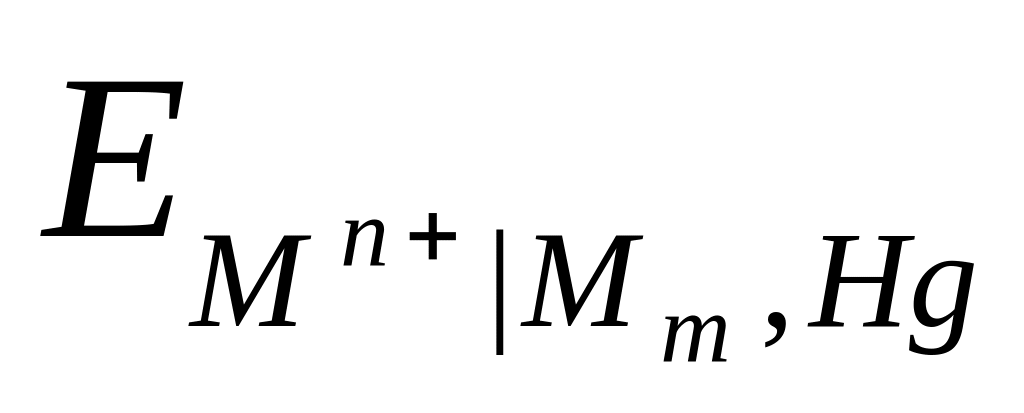 =
=  + 2,303
+ 2,303 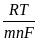 lg
lg 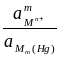 ,
,
то есть потенциал зависит от активности ионов металла не только в растворе, но и в амальгаме. Если металл находится в ртути в атомарном состоянии (m = 1), то можно написать:
= + 2,303 lg 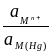 .
.
Амальгамные электроды широко применяются в технике и в лабораторной практике. Кадмиевый амальгамный электрод Cd2+ Cd, Hg (Cd2+ + 2e Cd (Hg)) в виде амальгамы, содержащей 12,5% Cd, используется для изготовления нормальных элементов Вестона, ЭДС которых практически не изменяется со временем. Кроме того, амальгамные электроды – практически единственные электроды (если не принимать во внимание ионселективные электроды, их следует рассматривать особо), которые могут быть обратимы по отношению к ионам щелочных и щелочноземельных металлов.
Электроды в котрорых амальгама какого-либо металла находится в контакте с раствором, содержащим ионы этого металла
Электроды второго рода
Электродами второго роданазываются электроды, обратимые относительно катиона и аниона. В потенциалопределяющей реакции на этом электроде принимают участие как катионы, так и анионы. Такие электроды представляют собой систему, состоящую из металла, покрытого слоем трудно растворимой соли, погруженного в раствор, содержащий одноименные анионы с трудно растворимой солью.
состоят из металла, покрытого слоем трудно растворимой соли.
Газовые электроды
Газовый электрод представляет собой полуэлемент, состоящий из металлического проводника, контактирующего одновременно с соответствующим газом и с раствором, содержащим ионы этого газа. Конструирование газового электрода невозможно без участия проводника с электронной проводимостью. Требования к металлу в газовых электродах: 1) должен ускорять медленно устанавливающееся электродное равновесие, то есть служить катализатором электродной реакции; 2) потенциал металла в газовом электроде не должен зависеть от активности других ионов раствора, в частности от активности собственных ионов металла; 3) должен быть инертным по отношению к другим возможным реакциям; 4) должен обеспечивать создание максимально развитой поверхности раздела между фазами, на которой могла бы протекать обратимая реакция ионизации газа. Всем этим требованиям лучше всего удовлетворяет платина, электролитически покрытая платиновой чернью (платинированная платина). Газовые электроды очень чувствительны к изменению состояния поверхности платины, особенно к отравлению ее каталитическими ядами.
Водородный электрод. Схема электрода:
H+ H2 Pt .
Электродная реакция: 2Н+ + 2е = Н2 ;
 =
=  + 2,303
+ 2,303 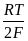 lg
lg  = 2,303 lg
= 2,303 lg 2,303 lg
2,303 lg
(так как 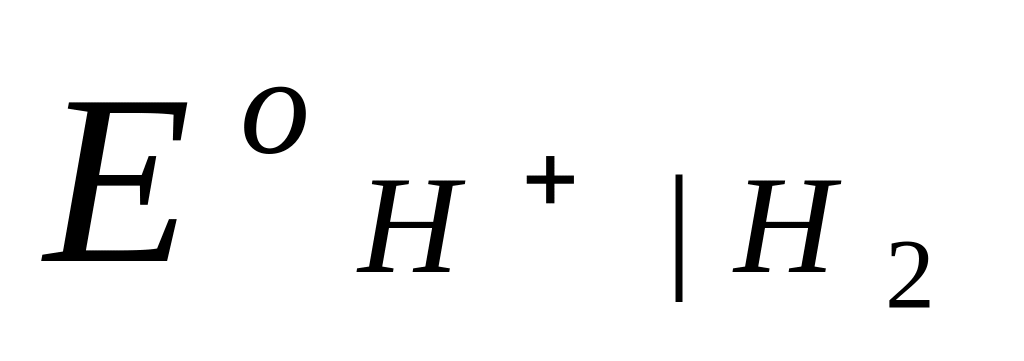 при всех Т принят равным нулю). При невысоких давлениях газообразного водорода (f р) летучесть можно заменить на давление:
при всех Т принят равным нулю). При невысоких давлениях газообразного водорода (f р) летучесть можно заменить на давление:
= 2,303 lg 2,303 lg .
.
Таким образом, потенциал водородного электрода определяется не только активностью ионов Н+, но и парциальным давлением газообразного водорода, следовательно, водородный электрод (как и все газовые электроды) более сложен, чем электроды первого и второго рода, потенциалы которых зависят непосредственно от активности частиц одного сорта.
Когда парциальное давление водорода равно 1 атм, уравнение упрощается: = 2,303 рН , то есть при определенных условиях потенциал водородного электрода дает непосредственное значение рН и, следовательно, его можно использовать как индикаторный электрод при определении рН в растворах кислот и щелочей любых концентраций, что очень существенно, так как другие индикаторные электроды (стеклянный, хингидронный, металлоксидные) можно использовать лишь в ограниченном интервале рН.
Другое важное применение газового водородного электрода: при поддержании постоянного значения рН и давления газообразного водорода его можно использовать как электрод сравнения на границе с любыми кислыми и щелочными растворами, причем диффузионный потенциал можно практически свести к нулю подбором соответствующего раствора в водородном электроде.
Кислородный электрод. Схема электрода:
ОН– О2 Pt .
Электродная реакция: О2 + 2Н2О + 4е = 4ОН– ;
 =
=  + 2,303
+ 2,303  lg
lg  =
=
+ 2,303 lg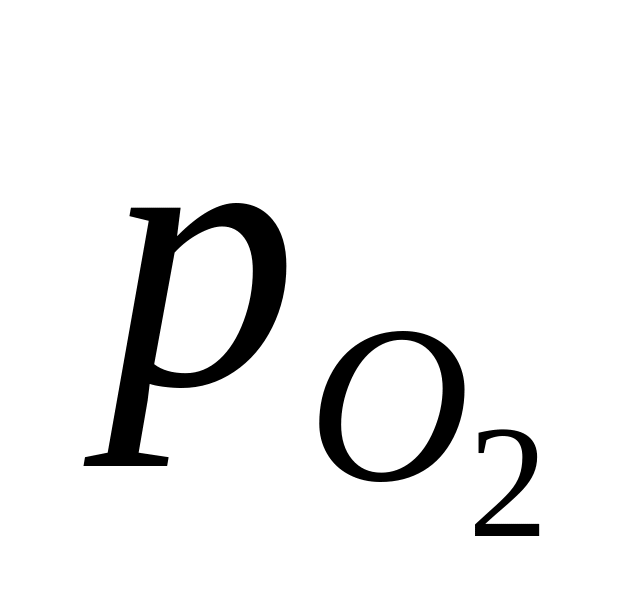 2,303 lg .
2,303 lg .
В величину включена активность воды. При 25оС и = 1 атм
= 0,401 0,059 lg .
Однако реализовать обратимый кислородный электрод на практике весьма трудно. Это обусловлено способностью кислорода окислять металлы, даже платину, поэтому на основную электродную реакцию накладывается реакция, отвечающая металлоксидному электроду второго рода. Кроме того, часть кислорода восстанавливается на электроде не до ионов гидроксила, а до ионов перекиси водорода. Поэтому значения потенциала кислородного электрода, полученные опытным путем, обычно не совпадают с теоретическими, и кислородный электрод не используется на практике ни в качестве индикаторного электрода при определении рН, ни в качестве электрода сравнения, хотя теоретически и то и другое возможно.
Хлорный электрод. Реализация обратимого газового хлорного электрода Cl– Cl2 Pt связана со значительными трудностями. Теоретически электродная реакция здесь проста: Cl2 + 2e = 2Cl– и электродный потенциал можно описать уравнением
 =
=  + 2,303 lg
+ 2,303 lg  .
.
Однако на основной электродный процесс накладываются побочные реакции с участием хлора. Высокое положительное значение (+ 1,358 В при 25оС) затрудняет подбор устойчивого, не реагирующего с хлором материала электрода. Тем не менее при соблюдении определенных мер удалось получить опытные значения потенциалов хлорного электрода, совпадающие с теоретической величиной.
Сравнивая выражения для потенциалов газовых электродов, можно заметить, что при повышении давления соответствующего газа потенциал водородного электрода смещается в отрицательную сторону, а потенциалы кислородного и хлорного электродов – в положительную.
состоящий из металлического проводника, контактирующего одновременно с соответствующим газом и с раствором


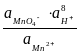 =
=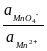 + 2,303
+ 2,303 
 Электроды медные сварочные применяются для ручной дуговой сварки инвертором (ММА) меди и ее сплавов. Работа ведется на постоянном токе с короткой дугой. При большой толщине деталей необходим предварительный подогрев, содействующий лучшему качеству шва.
Электроды медные сварочные применяются для ручной дуговой сварки инвертором (ММА) меди и ее сплавов. Работа ведется на постоянном токе с короткой дугой. При большой толщине деталей необходим предварительный подогрев, содействующий лучшему качеству шва. ЦЧ-4. В основном применяются для ремонтной наплавки на чугунные детали и для исправления дефектов в отливках – пор, раковин, недоливов, трещин и т. д. Часто ими наплавляют только первые 1–2 слоя, далее наплавка продолжается электродами других марок, что дает более эффективный результат. Кроме того, эта марка используется для сварки деталей из чугуна и нержавеющих сталей, варить можно с предварительным подогревом и без него.ОЗЧ-4. Используются для холодной сварки и наплавки. Стержни имеют никелевую основу. Для марки характерна низкая проплавляющая способность. Использовать электроды рекомендуется для наплавки завершающих слоев – металл шва получает повышенную ударную вязкость и стойкость к истиранию. Присадочный материал наплавляется на постоянном токе обратной полярности в вертикальном и нижнем положении.
ЦЧ-4. В основном применяются для ремонтной наплавки на чугунные детали и для исправления дефектов в отливках – пор, раковин, недоливов, трещин и т. д. Часто ими наплавляют только первые 1–2 слоя, далее наплавка продолжается электродами других марок, что дает более эффективный результат. Кроме того, эта марка используется для сварки деталей из чугуна и нержавеющих сталей, варить можно с предварительным подогревом и без него.ОЗЧ-4. Используются для холодной сварки и наплавки. Стержни имеют никелевую основу. Для марки характерна низкая проплавляющая способность. Использовать электроды рекомендуется для наплавки завершающих слоев – металл шва получает повышенную ударную вязкость и стойкость к истиранию. Присадочный материал наплавляется на постоянном токе обратной полярности в вертикальном и нижнем положении.
 Неплавящиеся электроды изготовленные из вольфрама в основном применяются для аргонодуговой сварки. Могут состоять полностью из вольфрама, а также содержать смеси. Имеют повышенную износостойкость. Вольфрамовые электроды из чистого вольфрама обычно используют для сварки на переменном токе, а электроды с активирующими добавками для сварки на переменном и постоянном токе прямой и обратной полярности.
Неплавящиеся электроды изготовленные из вольфрама в основном применяются для аргонодуговой сварки. Могут состоять полностью из вольфрама, а также содержать смеси. Имеют повышенную износостойкость. Вольфрамовые электроды из чистого вольфрама обычно используют для сварки на переменном токе, а электроды с активирующими добавками для сварки на переменном и постоянном токе прямой и обратной полярности.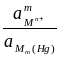 ,
,


