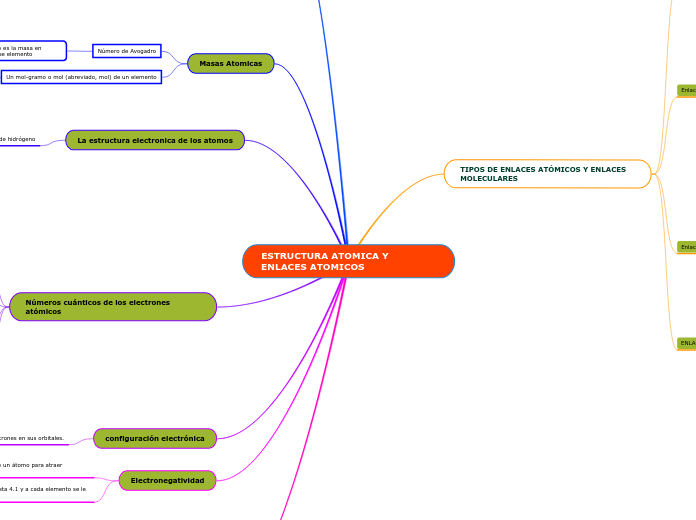
ESTRUCTURA ATOMICA Y ENLACES ATOMICOS
Estructura de los atomos
el numero de protones existente en el nucleo es igual
al numero atomico del elemento
atomos de un mismo elemento con un numero diferente de electrones en el nucleo
ISOTOPOS
numero de avogadro 0.625x10^24 uma /g
numero de electrones o protones que se necesita para producir una masa de 1gramo
El atomo esta constituido por una serie de electrones orbitando alrededor del nucleo
Cada proton o neutron tiene una masa aproximada de 1.6x10^24 g
Electronegatividad
se mide en una escala de 0 hasta 4.1 y a cada elemento se le asigna un valor en esta escala
se define como la capacidad de un átomo para atraer electrones hacia sí.
configuración electrónica
representa la distribución de los electrones en sus orbitales.
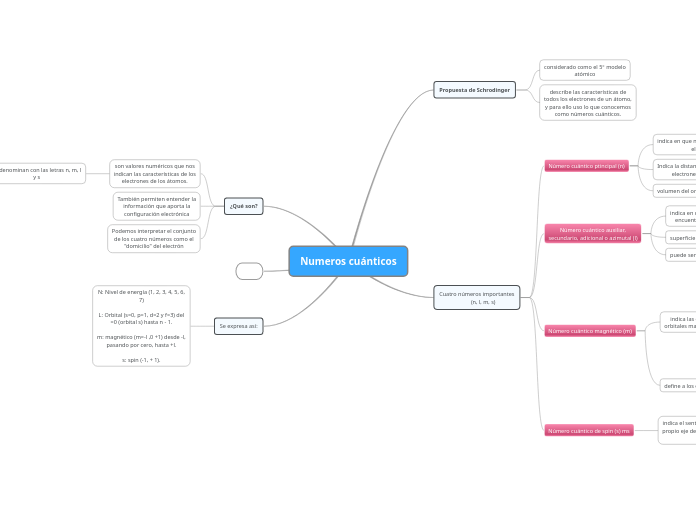
Números cuánticos de los electrones atómicos
El número cuántico de giro del electrón ms
sus valores permitidos son + 1/2 y − 1/2
pin ms, expresa las dos direcciones de giro permitidas para el giro del electrón en torno a su propio eje.
El número cuántico magnético m
define la orientación espacial de un orbital atómico y afecta poco la energía de un electrón.
El número cuántico ml tiene valores permisibles entre –l y +l, incluso cero.
Cuando l = 1, hay tres valores permitidos para ml, que son −1, 0, y +1
Cuando l = 0, sólo hay un valor permitido para m
El número cuántico secundario l
Este número cuántico especifica los subniveles de energía dentro de los niveles energéticos principales (subórbita)
Las letras s, p, d y f se emplean6 para denominar los subniveles energéticos l
Los valores permitidos de l son l = 0, 1, 2, 3,..., n − 1
onde la probabilidad de encontrar un electrón es alta si ese nivel energético está ocupado.
El número cuántico principal n
Representa los niveles energéticos principales del electrón o las órbitas
Cuanto mayor sea el valor de n, mayor será la energía electrónica y la posibilidad de que el electrón esté más alejado del núcleo.
Los valores de n son números enteros positivos y varían entre 1 y 7.
La estructura electronica de los atomos
El átomo de hidrógeno
el electrón del hidrógeno emitirá una cantidad determinada de energía (cuanto) en forma de radiación electromagnética llamada fotón
ecuación de Planck: ∆E=h v
es el átomo más simple y consta de un electrón que rodea a un núcleo de un protón
Masas Atomicas
Un mol-gramo o mol (abreviado, mol) de un elemento
e define como el número en gramos de ese elemento igual al número que expresa su masa atómica relativa molar
Número de Avogadro
La masa atómica relativa de un elemento es la masa en gramos de 6.023 × 10^23 átomos de ese elemento
Numeros atomicos y masas atomicas
Numero atomico
se ubican encima de los símbolos atómicos de los elementos en la tabla periódica
Los números atómicos de los elementos desde el hidrógeno, que tiene un número atómico de 1, hasta el hahnio, cuyo número atómico es 105
indica el número de protones (partículas cargadas positivamente) que están en su núcleo y en un átomo neutro
Cada elemento tiene su propio número atómico característico y, de este modo, el número atómico define al elemento.
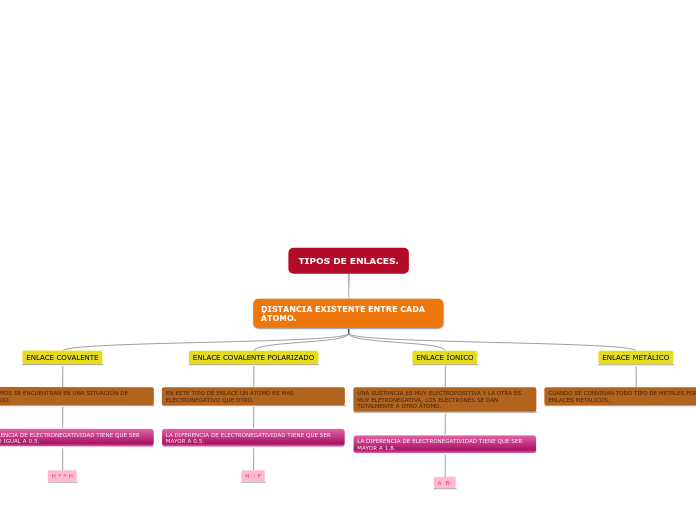
TIPOS DE ENLACES ATÓMICOS Y ENLACES MOLECULARES
ENLACE COVALENTE
los átomos generalmente comparten sus electrones externos s y p con otros átomos, de modo que cada átomo alcanza la configuración electrónica de gas noble.
se forma entre átomos con pequeñas diferencias de electronegatividad y ubicados muy próximos en la tabla periódica.
Enlaces atómicos secundarios y moleculares
Enlaces dipolares variables.
A este tipo de enlaces se les llama variables debido a que la densidad electrónica continuamente cambia con el tiempo
Entre los átomos puede formarse un enlace dipolar muy débil debido a la distribución asimétrica de las densidades electrónicas alrededor de sus núcleos
Enlaces de dipolo permanente.
El dipolo en una molécula existe debido a la asimetría en la distribución de su densidad electrónica
Corresponden a enlaces intermoleculares relativamente débiles que se forman entre moléculas que tienen dipolos permanentes
Enlaces atómicos primarios
Enlaces metálicos.
Implican fuerzas interatómicas relativamente grandes creadas cuando se comparten electrones en forma deslocalizada para formar un enlace fuerte no direccional entre los átomos.
Enlaces iónicos.
El enlace iónico es un enlace no direccional relativamente fuerte.
En este tipo de enlace intervienen fuerzas interatómicas relativamente grandes debidas a la transferencia de un electrón de un átomo a otro produciéndose iones que se mantienen unidos por fuerzas culombianas
Enlaces covalentes.
Corresponden a fuerzas interatómicas relativamente grandes creadas cuando se comparten electrones para formar un enlace con una dirección localizada.
en los cuales intervienen grandes fuerzas interatómicas, pueden subdividirse en las tres clases siguientes
El enlace químico entre átomos ocurre debido a la disminución neta de la energía potencial de los átomos en estado enlazado