Tema 3. Energía
Energía mecánica
Energía potencial
Energía cinética
Tema 2. Cinemática
Movimiento circular
Movimiento parabólico
Movimiento rectilíneo uniformemente desacelerado
Movimiento rectilíneo uniformemente acelerado
Estos dos subtemas se abordarán en el aula de prácticas, donde veremos ejemplos reales de estos movimientos y compararemos los resultados experimentales con los cálculos teóricos
Movimiento rectilíneo uniforme
Tema 1. Concepto de masa, volumen y densidad
Tema 8. Reacciones ácido-base
Tema 7. Reacciones de gases ideales
Tema 6. Termodinámica
Es conveniente que tengáis muy claros los conceptos termodinámicos que trataremos en el tema 6 para abordar los temas 7 y 8
Tema 5. Cálculos estequiométricos
Hipervínculo: problemas de repaso para trabajar en clase
Tema 4. Enlace Químico y otras interacciones atómicas
Enlace químico
Enlace iónico del cloruro de sodio, donde sodio da su electrón de valencia al cloro para ambos tener 8 electrones de valencia.
Un enlace químico es el proceso químico responsable de las interacciones atractivas entre átomos y moléculas,1y que confiere estabilidad a los compuestos químicos diatómicos y poliatómicos. La explicación de tales fuerzas atractivas es un área compleja que está descrita por las leyes de la química cuántica.
Es la fuerza existente entre los átomos una vez que se ha formado un sistema estable.2
Las moléculas, cristales, metales y gases diatómicos (que forman la mayor parte del ambiente físico que nos rodea) están unidos por enlaces químicos, que determinan las propiedades físicas y químicas de la materia.
Las cargas opuestas se atraen porque al estar unidas adquieren una situación más estable que cuando estaban separadas. Esta situación de mayor estabilidad suele darse cuando el número de electrones que poseen los átomos en su último nivel es igual a ocho, estructura que coincide con la de los gases nobles ya que los electrones que orbitan el núcleo están cargados negativamente, y que los protones en el núcleo lo están positivamente, la configuración más estable del núcleo y los electrones es una en la que los electrones pasan la mayor parte del tiempo "entre" los núcleos, que en otro lugar del espacio. Estos electrones hacen que los núcleos se atraigan mutuamente.
Enlace covalente
El enlace covalente polar es intermediado en su carácter entre un enlace covalente y un enlace iónico. Los enlaces covalentes polares se forman con átomos distintos con gran diferencia de electronegatividades. La molécula es eléctricamente neutra, pero no existe simetría entre las cargas eléctricas originando la polaridad, un extremo se caracteriza por ser electropositivo y el otro electronegativo.
Los enlaces covalentes pueden ser simples cuando se comparte un solo par de electrones, dobles al compartir dos pares de electrones, triples cuando comparten tres pares de electrones, o cuádruples cuando comparten cuatro pares de electrones.
La diferencia entre enlace simple doble y triple reside en que en un enlace simple los átomos están más alejados, lo que hace al enlace más débil (menor energía) por el contrario en uno triple los átomos están más cerca que en el simple, esto hace al enlace más energético y más fuerte por lo tanto más energético.6
.Los enlaces covalentes no polares (0 o menor que 0,4)7 se forman entre átomos iguales, no hay variación en el número de oxidación. Los átomos enlazados de esta forma tienen carga eléctrica neutra.
En otras palabras, el enlace covalente es la unión entre átomos en donde se da un compartimiento de electrones, los átomos que forman este tipo de enlace son de carácter no metálico. Las moléculas que se forman con átomos iguales (mononucleares) presentan un enlace covalente pero en donde la diferencia de electronegatividades es nula.
Se presenta entre los elementos con poca diferencia de electronegatividad (< 1.7), es decir cercanos en la tabla periódica de los elementos químicos o bien, entre el mismo elemento para formar moléculas diatómicas.
Un enlace covalente es la unión química entre un elemento no metálico con otro no metálico. Dentro de estos se puede encontrar una clasificación según el tipo de enlace; existiendo el enlace sencillo (en el cual comparte un solo par de electrones); ejemplo del mismo se encuentra la molécula de ácido clorhídrico; el segundo es el enlace doble (en el cual se comparten dos pares de electrones); siendo ejemplo de ello la molécula de dióxido de carbono; el último caso representa lo que se define como triple enlace (en el cual se comparten tres pares de electrones); siendo ejemplo de ello la molécula diatómica de nitrógeno. Dentro de sus propiedades se encuentran: variedad en sus puntos de ebullición y fusión; geometrías moleculares definidas. polaridad del enlace debido a electronegatividades que difieren la carga eléctrica parcial del átomo enlazado. Se pueden encontrar como enlace covalente puro u homopolar (unión de dos o más átomos del mismo elemento) siendo ejemplo O₂; como enlace covalente polar o heteropolar (unión entre dos no metales diferentes) ejemplo de ello H₂O; por último el covalente coordinado (en la que un átomo se coordina para completar su octeto) siendo ejemplo el H₂SO4.
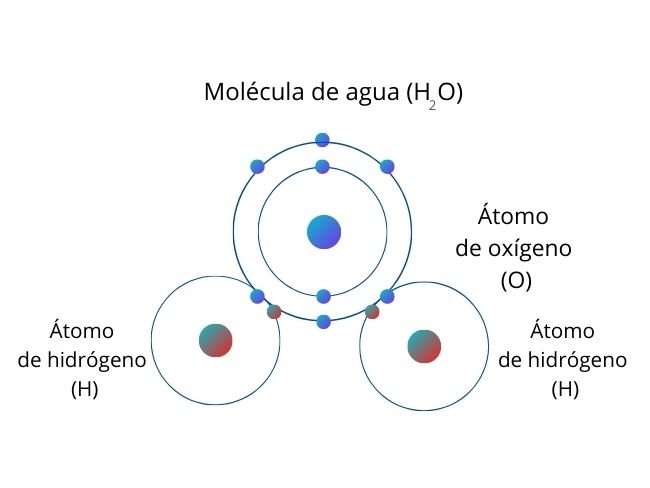
Enlace iónico
El enlace iónico es un tipo de interacción electrostática entre átomos que tienen una gran diferencia de electronegatividad. No hay un valor preciso que distinga la ionicidad a partir de la diferencia de electronegatividad, pero una diferencia sobre 2.0 suele ser iónica, y una diferencia menor a 1.7 suele ser covalente. En pocas palabras, un enlace iónico es aquel en el que los elementos involucrados aceptan o pierden electrones (se da entre un catión y un anión) o dicho de otra manera, es aquel en el que un elemento que tiene más electronegatividad se atrae con los elementos de menor electronegatividad.8 El enlace iónico implica la separación en iones positivos y negativos. Las cargas iónicas suelen estar entre –3e a +3e, este tipo de enlace es frecuente entre átomos de los grupos IA, IIA, IIIA que pierden electrones (Cationes) y átomos de los grupos VA, VIA, VIIA que ganan electrones (aniones).

Enlace metálico
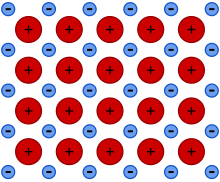
En un enlace metálico, los electrones de enlace se encuentran situados en una estructura de átomos. En contraste, en los compuestos iónicos, la ubicación de los electrones enlazantes y sus cargas son estáticas. Debido a la deslocalización o el libre movimiento de los electrones, se tienen las propiedades metálicas de conductividad, ductilidad y dureza. El enlace metálico es similar al iónico; sin embargo, el primero es más compacto que el segundo, ya que el número de átomos que rodean a cada uno de ellos es mayor.
Con base en la estructura del enlace metálico es posible identificar las propiedades más características de los metales, tales como su conductividad eléctrica y calorífica (conductividad), la capacidad para extenderse en hilos muy finos (ductilidad) , la capacidad para obtener láminas finas (maleabilidad), densidades elevadas, puntos de fusión altos... etc.
El modelo más sencillo de enlace metálico se basa en una de las propiedades características de los metales: su baja electronegatividad (ceden electrones con facilidad). Así pues, el enlace metálico podemos describirlo como una distribución muy ordenada y compacta de iones positivos del metal (red metálica) entre los cuales se distribuyen los electrones perdidos por cada átomo a modo de “nube electrónica”. Es importante observar que los electrones pueden circular libremente entre los cationes, no están ligados (sujetos) a los núcleos y son compartidos por todos ellos. Esta nube electrónica hace de “colchón” entre las cargas positivas impidiendo que se repelan, a la vez que mantienen unidos los átomos del metal.
Características principales de los metales:
Sólidos a temperatura ambiente (a excepción del mercurio) de densidad elevada.
La red metálica es una estructura muy ordenada (típica de los sólidos) y compacta (con los iones muy bien empaquetados, muy juntos, densidad alta)
Temperaturas de fusión y ebullición altas.
Buenos conductores del calor y la electricidad.
Ductilidad y maleabilidad, debido a la posibilidad de que las capas de iones se pueden deslizar unas sobre otras sin que se rompa la red metálica.
Tema 3. Formulación inorgánica y Formulación Orgánica
Conviene que os repaséis la formulación del año pasado.
ES UN REQUISITO INDISPENSABLE PARA APROBAR LA ASIGNATURA EL APROBAR LOS EXAMENES DE FORMULACIÓN
Tema 2.Configuración electrónica de los elementos químicos
Para los ejercicios y el examen de esta parte se os facilitará el número atómico y másico de los elementos, no es necesario estudiarse la tabla periódica.
Tema 1. La Tabla Periodica y modelos atómicos
Física y Química
Física
Tercer cuatrimestre
Química
Segundo trimestre
Primer trimestre