by Eber Isaí Montúfar Lopez 2 years ago
457
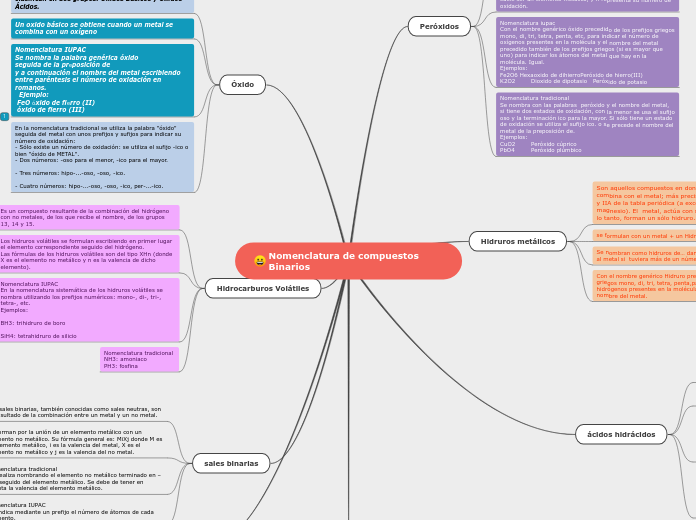
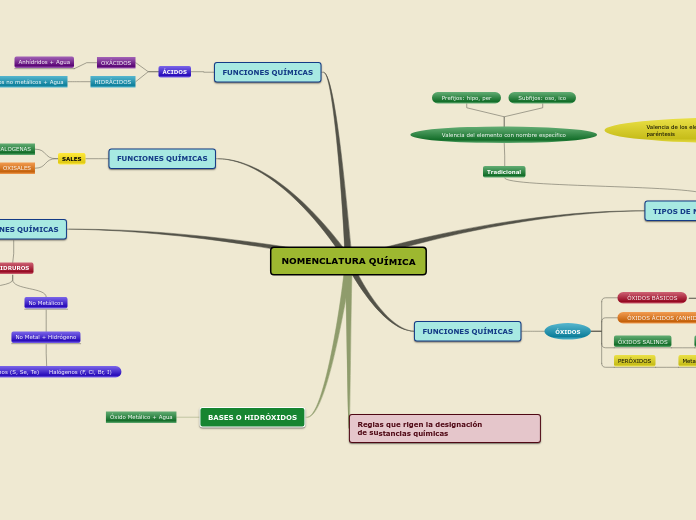
Nomenclatura de compuestos Binarios
La nomenclatura de los compuestos binarios abarca diferentes categorías según la combinación de elementos. Los hidruros metálicos se forman cuando el hidrógeno se combina con metales de los grupos IA y IIA de la tabla periódica, salvo el berilio y el magnesio.