Proteínas
Estructura de las proteínas
Estructura terciaria
Tipos de estructura terciaria
La estructura secundaria se pliega en proteínas esferoidales compactas, solubles en agua, que realizan funciones reguladoras o de transporte, y contienen hélices α, láminas β y giros β.
Las cadenas R polares se localizan en el exterior, permitiendo que estas proteínas sean solubles en agua y en soluciones salinas. Una excepción: proteínas de membrana, hacia la superficie sus aa hidrofóbicos.
Las cadenas R apolares se disponen hacia el interior de la molécula, formando un núcleo compacto hidrofóbico.
Proteínas fibrosas o filamentosas.
Las proteínas fibrosas, insolubles en agua, tienen cadenas polipeptídicas extendidas con alto contenido de aminoácidos hidrofóbicos y funciones de soporte y protección.
Importancia de la estructura terciaria
Las chaperonas ayudan al plegamiento correcto de proteínas, facilitan su transporte, degradan las dañadas y protegen el proteoma, participando también en la respuesta inmunitaria.
La estructura terciaria define la función de las proteínas, y alteraciones en el plegamiento pueden causar enfermedades, como el Alzheimer, asociado a proteínas mal plegadas que forman placas seniles en el cerebro.
Disposición que adopta la proteína nativa en el espacio. Formada por un conjunto de plegamientos característicos originados por las interacciones entre las cadenas laterales R de los aminoácidos situados a lo largo de la cadena, que pueden estar muy alejados entre sí.
Enlaces que estabilizan la estructura terciaria
Enlaces no covalentes
Puentes de hidrógeno
Interacciones hidrofóbicas y fuerzas de Van der Waals
Fuerzas electrostáticas
Enlaces covalentes
Enlace amida
Enlace disulfuro
Estructura cuaternaria
La estructura cuaternaria es la asociación de varias cadenas polipeptídicas (protómeros) mediante interacciones débiles o enlaces covalentes, formando proteínas oligómeras como dímeros (citocromo C) o tetrámeros (hemoglobina). Estas interacciones permiten modificaciones conformacionales esenciales para funciones biológicas, como el transporte de oxígeno (hemoglobina) o la respuesta inmune (anticuerpos).
La actividad biológica de las proteínas depende de su estructura tridimensional. Existen cuatro niveles de organización estructural: primario, secundario, terciario y cuaternario, siendo la conformación nativa la más estable y funcional.
Estructura secundaria
La estructura secundaria es la disposición espacial de la secuencia de aminoácidos, que se estabiliza por el giro de los carbonos α. Los tipos principales son la hélice α y la conformación β o lámina plegada, con algunas variaciones en diferentes proteínas.
Hélice α
La hélice α es un enrollamiento estabilizado por puentes de hidrógeno entre aminoácidos, con 3,6 aminoácidos por vuelta. Las cadenas laterales quedan hacia el exterior.
Conformación β
La conformación β o lámina plegada se forma por segmentos extendidos de dos cadenas polipeptídicas unidas por puentes de hidrógeno transversales. Adoptan una estructura en zigzag, con las cadenas laterales de los aminoácidos alternando por encima y por debajo de la hoja.
Disposición antiparalela
Direcciones opuestas del N y C terminales. Más estable. Ej: β-queratina, que constituye la fibroína de la seda.
Disposición paralela
Puentes de H entre distintas cadenas peptídicas adyacentes = misma dirección de los extremos N terminal y C terminal.
Estructuras supersecundarias
Los motivos estructurales son agrupaciones estables de estructuras secundarias que se repiten en diferentes partes de la cadena polipeptídica, comunes en proteínas globulares.
Grecas
Meandros
Motivos β α β
Dominios estructurales
Los dominios son unidades compactas y estables de proteínas grandes, formadas por combinaciones de hélices α y láminas β, de entre 40-300 aminoácidos. Se conectan mediante porciones flexibles, como bisagras, y suelen estar relacionados con funciones específicas, como la unión de nucleótidos en algunas enzimas.
Giros β
El giro β permite que la cadena polipeptídica cambie de dirección, con puentes de hidrógeno entre los restos 𝑛 y 𝑛+3. Se encuentra frecuentemente entre segmentos adyacentes y antiparalelos de una lámina β plegada.
Hélice de colágeno
El colágeno, presente en los tejidos conectivos como los tendones, tiene una hélice levógira formada principalmente por prolina e hidroxiprolina. Esta estructura, más extendida que la hélice α, da una vuelta por cada tres aminoácidos y mide 0,29 nm.
Estructura primaria
La estructura primaria de una proteína es la secuencia lineal de aminoácidos, que determina su forma y función. Con 20 aminoácidos, se pueden formar muchas cadenas, y las proteínas suelen tener más de 100 aminoácidos.
La secuencia de aa está determinada genéticamente por la secuencia de nucleótidos del ADN. Muchas enfermedades genéticas = secuencia anormal de aa que altera la estructura primaria y origina proteínas distintas. Lo que altera sus funciones.
Esto permite construir un árbol filogenético de la evolución de esta proteína a medida que aparecen nuevas especies.
Más alejadas evolutivamente, más diferencias en la estructura primaria de proteínas análogas.
Clasificación de las proteínas
Heteroproteínas o proteínas conjugadas
Nucleoproteínas
GP: un ácido nucleico, ADN o ARN. Ej: ribosomas (con ADN) y cromatina (con ARN).
Fosfoproteínas
Fosfoproteínas
GP: un ácido fosfórico.Ej: caseína (leche) y vitelina (yema del huevo).
Cromoproteínas
De naturaleza no porfirínica
De naturaleza porfirínica
Peroxidasas, catalasas y citocromos
El grupo prostético hemo, con hierro (Fe³⁺), se encuentra en enzimas y citocromos, que actúan como transportadores de electrones en células aerobias.
Hemoglobina y mioglobina
El grupo prostético hemo, con hierro (Fe²⁺) y color rojo, se encuentra en hemoglobina (eritrocitos) y mioglobina (músculos estriados), donde transportan oxígeno.
Lipoproteínas
Lipoproteínas sanguíneas
Lipoproteínas de alta densidad (HDL)
Transportan al hígado el colesterol de los tejidos, donde se metaboliza. “Colesterol bueno”.
Lipoproteínas de baja densidad (LDL y VLDL)
Transportan colesterol del hígado e intestino a los tejidos para formar membranas celulares. En exceso, taponan las arterias, conocido como "colesterol malo".
Quilomicrones (QM)
Formados en la mucosa intestinal (enterocitos) por unión de ácidos grasos, glicerina y colesterol. Transportan lípidos adquiridos en la dieta del intestino (a la linfa, a la sangre) a los tejidos: músculo, tejido adiposo e hígado.
Lipoproteínas estructurales
Glucoproteínas
Enzimas
Regulan reacciones químicas como la respiración celular o la replicación del ADN.
Ejemplos incluyen la hormona folículoestimulante (FSH), la hormona tirotropina (TSH) y la hormona luteinizante (LH).
Glucoproteínas integrales de membrana
Asociadas lípidos de la bicapa de las membranas celulares.
Glucoproteínas sanguíneas
Glucoproteínas sanguíneas. Destacan: inmunoglobulinas, el fibrinógeno y las de la membrana de los eritrocitos.
Proteoglucanos
Parte del líquido sinovial, las secreciones mucosas y la pared bacteriana.
Holoproteínas o proteínas simples
Proteínas fibrosas o escleroproteínas
Elastina
Es flexible y elástica, recuperando su forma tras una fuerza. Se encuentra en tejidos de órganos sometidos a deformaciones reversibles, como piel, pulmones y vasos sanguíneos.
Fibrina
Interviene en la coagulación sanguínea, forma una entramado insoluble de células sanguíneas llamada coágulo.
Queratinas
Restos del aa cisteína. α-queratinas (piel, pelo, escamas, uñas, lana y cuero). β-queratina (fibras de seda y las telarañas).
Miosina
Contracción muscular.
Colágeno
Es la proteína más abundante en vertebrados, constituyendo más de 1/3 de la proteína total. Forma parte de la matriz extracelular del tejido conjuntivo, presente en piel, cartílagos, huesos, tendones y córnea.
Proteínas globulares
Junto con la miosina, las proteínas responsables de la contracción muscular, la citocinesis y la propulsión de los espermatozoides mediante flagelos.
Se distinguen de las prolaminas en que no coagulan por el calor. Ej: glutenina del trigo.
Protamínas
Básicas, pequeña masa molecular. Asociadas al ADN en los espermatozoides de todos los animales.
Histonas
Las proteínas de baja masa molecular y aminoácidos básicos forman parte de la cromatina, creando estructuras esféricas que enrollan el ADN para formar cromosomas, además de participar en la regulación génica.
Las proteínas globulares grandes incluyen lactoglobulina, ovoglobulina y seroglobulinas. Las α y β-globulinas transportan, y las γ-globulinas son anticuerpos.
Las proteínas regulan la presión osmótica, almacenan aminoácidos y transportan sustancias como hormonas y toxinas. Ejemplos: lactoalbúmina, ovoalbúmina y seroalbúmina.
Subtopic
Propiedades de las proteínas
Capacidad amortiguadora
Las proteínas son anfóteras, pueden liberar o captar H+, actuando como buffers que regulan el pH. Ejemplo: la hemoglobina en los eritrocitos mantiene el pH en 4,7.
Desnaturalización
La desnaturalización es la pérdida de la estructura tridimensional de una proteína por factores físicos o químicos, conservando solo su estructura primaria. Esto causa pérdida de función. Puede ser reversible si el daño es leve; si es grave, es irreversible.
Solubilidad
Las proteínas globulares son solubles en agua gracias a la capa de solvatación formada por sus aminoácidos polares. Al añadir sal, los iones compiten con las cargas de las proteínas; si la sal es muy concentrada, la capa de solvatación se pierde y las proteínas precipitan
Escleroproteiías
Glutelinas
Prolaminas
Globulinas
Albúminas
Especificidad
Las proteínas son específicas: actúan sobre sustratos o antígenos concretos y forman estructuras precisas. Las homólogas, similares entre especies, ayudan a estudiar la evolución.
Los péptidos y el enlace peptídico
Funciones biológicas de los péptidos
Antibióticos
Agentes vasoactivos
Neurotransmisores
Antioxidantes
Hormonas
Glucagón
Insulina
Somatostatina
Vasopresina
Oxitocina
Estructura de los péptidos
El enlace peptídico
El esqueleto del péptido se forma por la secuencia (-NH-CH-CO-). El enlace peptídico elimina el carácter anfótero de los aminoácidos, y las cadenas polipeptídicas pueden ser ácidas o básicas debido a los grupos R y los terminales.
El enlace peptídico, con carácter de doble enlace parcial, limita la rotación y afecta la conformación de los péptidos. Las proteínas tienen propiedades ácidas o básicas y su punto isoeléctrico es el pH donde su carga neta es cero.
Tipos de péptidos
Cuando se unen dos aminoácidos se forma un dipéptido, con tres se forma un tripéptido, y con cuatro un tetrapéptido, y así sucesivamente. Debido a que cada péptido tiene un grupo carboxilo y uno amino libres, la cadena puede seguir extendiéndose.
Proteínas. +100 y masas moleculares comprendidas entre 6000 - 1.000.000.
Polipéptidos. 12 - 100 aa.
Oligopéptidos. 2 - 12 aa.
Los aminoácidos se unen mediante un enlace peptídico, que es covalente y de tipo amida. Este enlace se forma entre el grupo carboxilo de un aminoácido y el grupo amino de otro, liberando una molécula de agua.
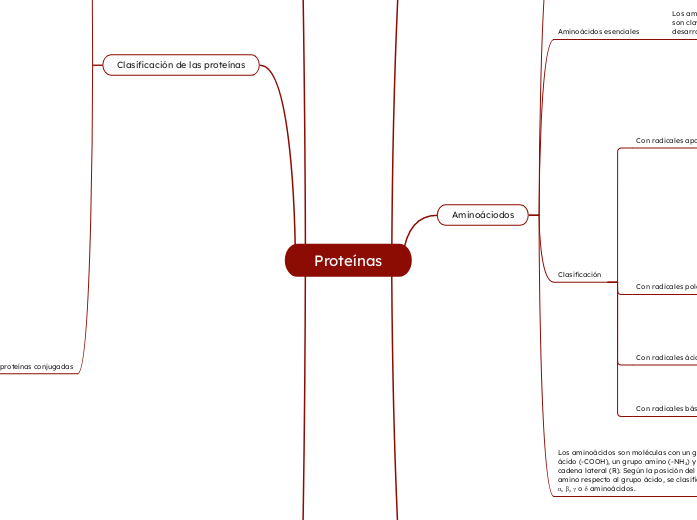
Aminoáciodos
Los aminoácidos son moléculas con un grupo ácido (-COOH), un grupo amino (-NH₂) y una cadena lateral (R). Según la posición del grupo amino respecto al grupo ácido, se clasifican como α, β, γ o δ aminoácidos.
Aminoácidos no proteinógenos (no forman parte de proteínas)
Parte de las paredes celulares bacterianas
Neurotransmisores.
Precursores en el metabolismo.
Aminoácidos proteinógenos (forman las proteínas)
Clasificación
Con radicales básicos
Histidina (His)
Arginina (Arg)
Lisina (Lys)
Con radicales ácidos
Ác.glutámico (Glu)
Ác.aspáratico (Asp)
Con radicales polares
Tirosina (Tyr)
Asparagina (Asn)
Glucamina (Gln)
Treonina (Thr
Serina (Ser)
Con radicales apolares
Gilicina (Gly)
Cisteína (Cys)
Triptofina Trp)
Fenilalnina (Phe)
Metionina (Met)
Prolina (Pro)
Isoleucina (Lle
Leucina (Leu)
Valina (Val)
Alamina (Ala)
Aminoácidos esenciales
Los aminoácidos esenciales, obtenidos de la dieta, son clave para sintetizar proteínas y garantizar el desarrollo.
El valor biológico de una proteína depende de los aminoácidos esenciales. Las proteínas animales son completas, mientras que las vegetales pueden complementarse al consumirse juntas.
Propiedades
Estereoisomería
Todos los aminoácidos, excepto la glicina, poseen un carbono asimétrico, el carbono α. Como consecuencia, los aminoácidos presentan estereoisomería y tienen actividad óptica.
En la naturaleza, todos los aminoácidos son isómeros L. Excepcionalmente, se encuentran D-aminoácidos en los péptidoglucanos y en ciertos antibióticos.
La electroforesis separa moléculas cargadas según su carga y el pH, utilizando un campo eléctrico y papel de celulosa como soporte.
Comportamiento químico
En disolución acuosa, los aminoácidos tienen un comportamiento anfótero, actuando como ácido o base según el pH. A pH fisiológico (~7), predominan los zwitteriones, formas dipolares con el grupo -COOH ionizado y el grupo -NH₂ protonado.
pH aumenta
aa carga negativa: el grupo –NH₃⁺ cede un H⁺ al medio, quedando la carga del grupo –COO⁻.
pH disminuye
aa carga positiva: los H⁺ del medio son captados por el grupo –COO⁻, quedando la carga del grupo –NH₃⁺.
Las proteínas son macromoléculas formadas por aminoácidos que expresan la información genética y desempeñan múltiples funciones esenciales en los seres vivos. Representan el 50 % del peso seco celular y participan en casi todas las actividades biológicas.
Funciones de las proteinas
Enzimática
Comunicación
Defensa
Movimiento
Transporte
Estructural