by Caro Rosales 4 years ago
1640
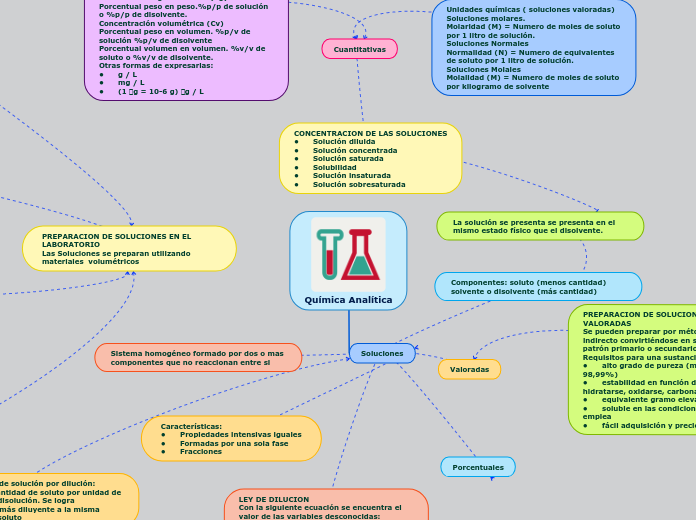
Química Analítica - MM
Concentración, Volumen, Soluciones, Dilución, Materiales, Rotulado 2. La ley de dilución permite calcular variables desconocidas relacionadas con la concentración y el volumen de soluciones químicas.