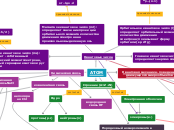
Цветной лом, пригодный к переработке
Al
Банки Отходы Упаковки
Автомобиль
Радиатор Мотор Диски
Pb
Аккумуляторы Свинцовые грузики
Mg
Детали самолётов Детали машин Типографское оборудование Автоприборы Отходы
Cu
Латунь Бронза Трубки Сплавы Бойлеры
Химические реакции
гетерогенные
гомогенные
эндотермические
экзотермические
обратимые
необратимые
неОВР
ОВР
Термодинамика
Энергия Гибса ∆Gх.р.=∑∆Gпрод.-∑∆Gисх. в-в
Классы неорганических соединений
сложные
соли
кислоты
основания
оксиды
простые
неМе
Me
Электронная оболочка
элекроны(e-)
Ядро
нейтроны(n)
протоны(p+)
АТОМ
Порядковый номер элемента в Периодической системе
количество электронов в атоме
количество протонов в ядре атома
Заряд ядра атома
Химическая связь
водородная связь HF
металлическая связь Al
Связь с металлургией
Пирометаллургия — восстановление металлов из руд при высоких температурах
металлотермия
алюминотермия Cr2O3+2Al→2Cr+Al2O3
карботермия SnO2+C→Sn+CO2
ионная связь NaCl
ковалентная связь
неполярная Cl2
полярная HCl
Квантовая механика-поведение движущихся микрообъектов
Принцип запрета Паули- невозможно существование двух электронов с одинаковым набором квантовых чисел. Отсюда следует, что электроны, расположенные на одной орбитали, могут различаться только значением спинового квантового числа
Принцип минимальной энергии - электроны заполняют орбитали в порядке увеличения их энергии. Последовательность увеличения энергии электронных орбиталей регламентируется правилами Клечковского
Принцип неопределенности : при малых значениях массы m нельзя одновременно с достаточной точностью
определить и скорость частицы v, и ее координату x
Луи де Бройль:электрон характеризуется корпускулярно-волновой двойственностью
Квантовые числа
Cпиновое квантовое число (ms) : пределяет - собственный механический момент электрона, связанный с вращением его вокруг своей оси
(-1/2·h/2 )или (+1/2· h/2 )
Магнитное квантовое число (ml) : определяет значение проекции орбитального момента количества движения электрона на произвольно выделенную ось
от –l до +l
Орбитальное квантовое число (l) : определяет орбитальный момент количества движения электрона;
показывает форму орбитали (s p d f g)
0,1...(n-1)
Главное квантовое число (n) : определяет энергию электрона
1,2,3...7
Строение (A=Z+N)