1102 pH Y CONCEPTO DE ACIDOS Y BASES (GRUPO 4)
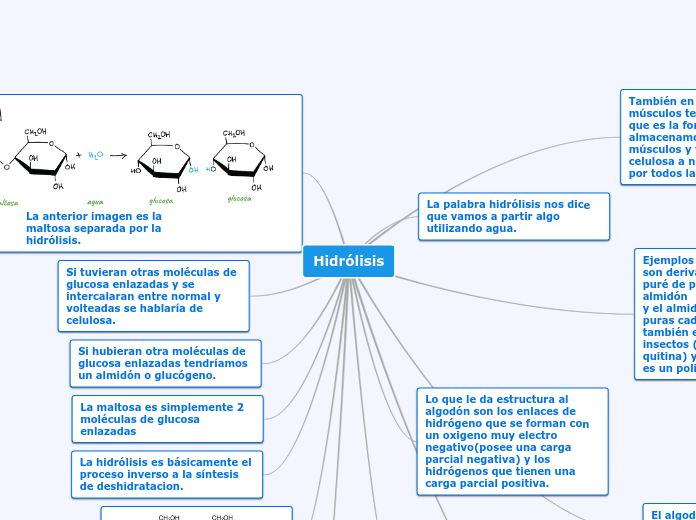
HIDROLISIS DE SALES DE ACIDOS Y BASES
El comportamiento en disolución de ácidos y bases está determinado por su grado de disociación:
Las disoluciones acuosas de las sales pueden presentar un comportamiento ácido o básico debido a que los iones procedentes de su disociación pueden reaccionar con el agua intercambiando protones (reacciones de hidrólisis). Como consecuencia de estas reacciones, las disoluciones acuosas de las sales presentan diferentes propiedades ácido-base.
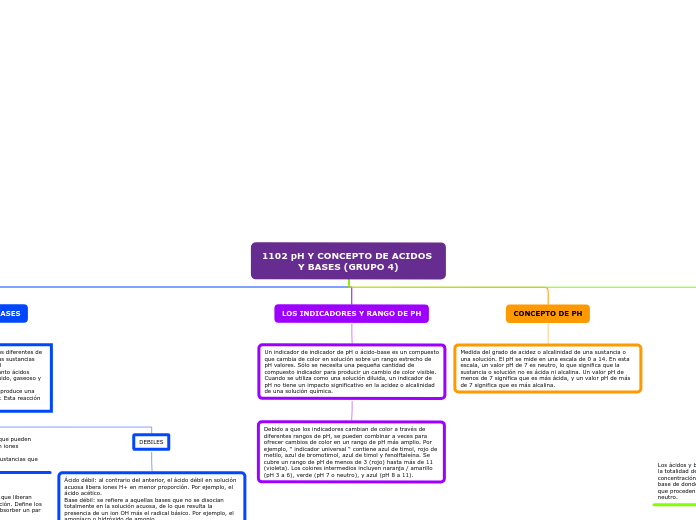
ACIDOS Y BASES DEBILES
Los ácidos y bases débiles se disocian parcialmente y por lo tanto, la concentración de los iones H+ o OH- es menor que la totalidad de sus grupos ionizables.
Para calcular el pH de sus disoluciones habrá que tener en cuenta su grado de disociación (a). Se ionizan solo parcialmente y la reacción de ionización es reversible.
ACIDOS Y BASES FUERTES
Los ácidos y bases fuertes se disocian por completo, es decir, la totalidad de los iones H+ u OH- están en forma libre, y su concentración dependerá de la concentración del ácido o de la base de donde provienen. Las disoluciones acuosas de sales que proceden de un ácido fuerte y una base fuerte tienen pH neutro.
CONCEPTO DE PH
Medida del grado de acidez o alcalinidad de una sustancia o una solución. El pH se mide en una escala de 0 a 14. En esta escala, un valor pH de 7 es neutro, lo que significa que la sustancia o solución no es ácida ni alcalina. Un valor pH de menos de 7 significa que es más ácida, y un valor pH de más de 7 significa que es más alcalina.
LOS INDICADORES Y RANGO DE PH
Un indicador de indicador de pH o ácido-base es un compuesto que cambia de color en solución sobre un rango estrecho de pH valores. Sólo se necesita una pequeña cantidad de compuesto indicador para producir un cambio de color visible. Cuando se utiliza como una solución diluida, un indicador de pH no tiene un impacto significativo en la acidez o alcalinidad de una solución química.
Debido a que los indicadores cambian de color a través de diferentes rangos de pH, se pueden combinar a veces para ofrecer cambios de color en un rango de pH más amplio. Por ejemplo, “ indicador universal “ contiene azul de timol, rojo de metilo, azul de bromotimol, azul de timol y fenolftaleína. Se cubre un rango de pH de menos de 3 (rojo) hasta más de 11 (violeta). Los colores intermedios incluyen naranja / amarillo (pH 3 a 6), verde (pH 7 o neutro), y azul (pH 8 a 11).
CONCEPTO DE ACIDOS Y BASES
En química se llaman ácidos y bases a dos tipos diferentes de sustancias opuestas entre sí. Cada una de estas sustancias reúne propiedades específicas que modifican el comportamiento de las soluciones químicas. Tanto ácidos como bases pueden encontrarse en estado líquido, gaseoso y sólido (el polvo).
Al juntarse ácidos y bases en una solución, se produce una reacción exotérmica, es decir, se produce calor. Esta reacción se conoce como neutralización
DEBILES
Ácido débil: al contrario del anterior, el ácido débil en solución acuosa libera iones H+ en menor proporción. Por ejemplo, el ácido acético.
Base débil: se refiere a aquellas bases que no se disocian totalmente en la solución acuosa, de lo que resulta la presencia de un ion OH más el radical básico. Por ejemplo, el amoníaco o hidróxido de amonio.
BASES:se llaman bases a aquellas sustancias que pueden captar iones de hidrógeno en solución o liberan iones negativos, llamados hidroxilos (OH-).
También se definen las bases como aquellas sustancias que aportan dos electrones a la solución
ACIDOS:e llaman ácidos a aquellas sustancias que liberan iones de hidrógeno positivos (H+) en una solución. Define los ácidos como sustancias que pueden recibir o absorber un par de electrones de la solución.
FUERTES
Ácido fuerte: es aquel que se cede la mayor parte de sus iones de hidrógeno en solución, lo que quiere decir que se ioniza con gran facilidad. Por ejemplo, el HCl o ácido clorhídrico.
Base fuerte: se refiere a una variedad de electrolito al que se le atribuye un carácter fuerte y que, por lo tanto, puede ionizarse totalmente en una solución acuosa. Por ejemplo, la soda cáustica.