door Shariel Miserendino Ardaya 3 jaren geleden
1498
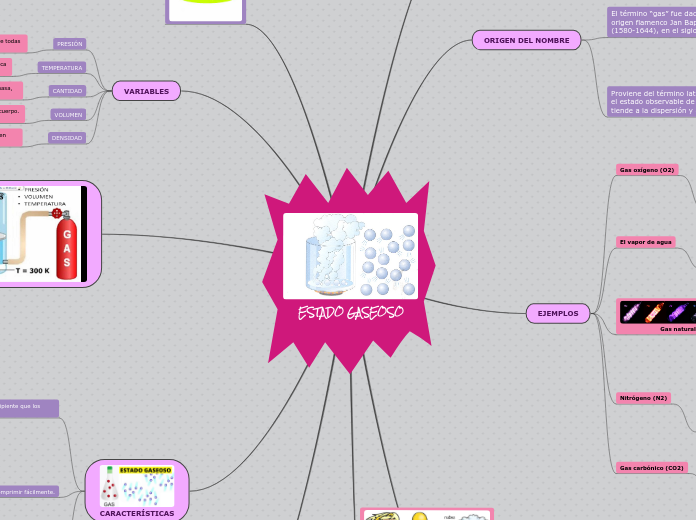
ESTADO GASEOSO
Los gases se distinguen por su capacidad para expandirse y adaptarse a la forma y volumen del recipiente que los contiene, debido a la ausencia de fuerzas de atracción intermolecular.