Importante saber que
cuando el sistema no acumula
masa respecto al tiempo
entonces:
m_dotin = m_dotout
Calor, temperatura y
transferencia de energía
Flujo volumétrico/caudal
Diagrama de propiedades
de cambio fases
FASES DE LA SUSTANCIAS
En los sistemas termodinámicos
normalmente se estudian
sustancias puras.
TIPOS DE
SUSTANCIAS PURAS
Las sustancias pueden presentar
cambios de fase según las
condiciones de temperatura y
presión a las que se encuentre,
para entender su comportamiento
se pueden hacer representaciones
gráficas de sus cambios.
VAPOR
SOBRECALENTADO
VAPOR
SATURADO
MEZCLA
Al presentarse una mezcla
en el STD se debe tener en
cuenta la calidad del gas
X=(masa de gas/masa total)
LIQUIDO
SATURADO
LIQUIDO
COMPRIMIDO
Dependiendo su factor
de compresibilidad ''Z''
pueden haber dos tipos.
Cuando Z=1
GASES IDEALES
Cuando 0 < Z < 1
GASES NO IDEALES
ECUACION DE ESTADO:
Pv=ZRT
FASES DE LAS
SUSTANCIAS PURAS
FASE
GASEOSA
FASE
LIQUIDA
FASE
SÓLIDA
propiedades intensivas y
extensivas.
Introducción. Leyes.
energía latente y sensible.
Sistemas abiertos y cerrados.
Relación entre
Cv y Cp
Cp - Cv = R
*R es la constante del gas*
ΔU = m*Cvprom*ΔT [kJ]
ENERGÍA TOTAL DEL SISTEMA
Se debe tener en cuenta que en en la vida real
los STD nunca presentan un 100% de eficiencia.
Esta ultima se calcula así:
n = (Eobtenida/Esuministrada)
La energía total de un sistema es la
sumatoria de todas entradas y salidas
de las energías internas, potencial y cinéticas
Etotalsitema = ΔU + ΔEk + ΔEp [kJ]
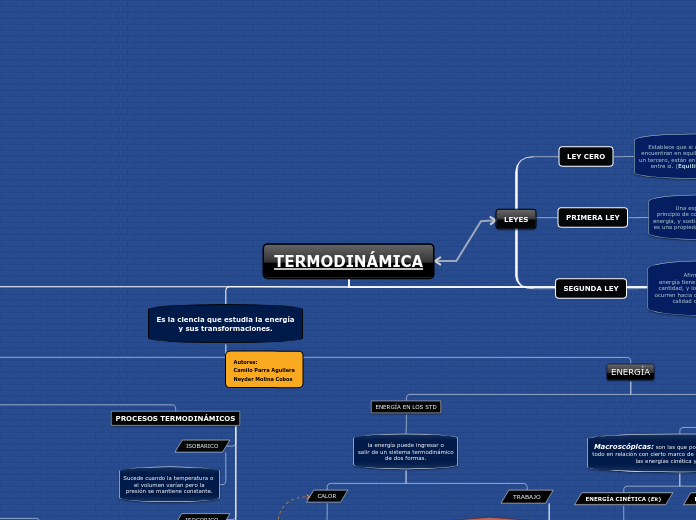
Autores:
Camilo Parra Aguilera
Neyder Molina Cobos
LEYES
SEGUNDA LEY
Afirma que la
energía tiene calidad así como cantidad, y los procesos reales ocurren hacia donde disminuye la calidad de la energía.
PRIMERA LEY
Una expresión del
principio de conservación de la energía, y sostiene que la energía es una propiedad termodinámica.
LEY CERO
Establece que si dos cuerpos se encuentran en equilibrio térmico con un tercero, están en equilibrio térmico entre sí. (Equilibrio térmico)
Subtopic
TERMODINÁMICA
Es la ciencia que estudia la energía
y sus transformaciones.
ENERGÍA
FORMAS DE ENERGÍA
Microscópicas: de energía son las que se relacionan con la estructura molecular de un sistema y el grado de la actividad molecular, y son independientes de los marcos de referencia externos.
ENERGÍA INTERNA (U)
Energía sensible:
energía necesaria para comenz-
zar un cambio de fase.
Energía latente:
energía necesaria para
elevar la energía de un fluido.
Macroscópicas: son las que posee un sistema como un todo en relación con cierto marco de referencia exterior, como las energías cinética y potencial
ENERGÍA POTENCIAL (Ep)
Ep = m*g*h [kJ]
ENERGÍA CINÉTICA (Ek)
Ek = (1/2)*m*V2 [kJ]
ENERGÍA EN LOS STD
la energía puede ingresar o
salir de un sistema termodinámico
de dos formas.
TRABAJO
TRABAJO DE FRONTERA MÓVIL
Wb = ∫P*dV ----> Ecuacion General
Wb = P*ΔV ----> cuando la presión
es constante!
TRABAJO DE FLECHA --> W = 2 *π*n*T
TRABAJO DE RESORTE --> W = (1/2)*k*Δx
TRABAJO POTENCIAL --> W = m*g*h
TRABAJO DE EMBOLO ---> W = P*Δv
TRABAJO ELÉCTRICO -----> W = V*I*Δt
w = W / m [kJ/kg]
CALOR
q = Q / m [kJ/kg]
calores específicos:
Calor a presión constante:
Cp = (dh/dT)pc
Calor a volumen constante:
Cv = (dv/dT)vc
Estos calores específicos se
calculan por tablas y además se
requieren para calcular el cambio
de la energía interna (ΔU) y el
cambio de las entalpías (ΔH).
Donde:
ΔU = Cvprom*ΔT [kJ/kg]
Δh = Cpprom*ΔT [kJ/kg]
SISTEMAS TERMODINÁMICOS
( STD )
PROCESOS TERMODINÁMICOS
DIABATICO
NO HAY CAMBIO DE ENERGÍA
(La energía no atraviesa el sistema)
ISOTERMICO
Este tipo de proceso sucede
cuando la temperatura del gas
permanece constante.
ADIABATICO
Sucede cuando en el sistema no
recibe ni calor ni trabajo.
el sistema no transfiere energía
con sus alrededores.
ISOCORICO
Este proceso se presenta cuando
la presion o la temperatura
varían pero el volumen es
constante. (Wt = 0)
ISOBARICO
Sucede cuando la temperatura o
el volumen varían pero la
presión se mantiene constante.
PROPIEDADES DE UN
SISTEMA TERMODINÁMICO
EXTENSIVAS
Propiedades que dependen
de la masa
ENERGÍA
ESPECÍFICA
*Capacidad para
hacer un trabajo*
e = E / m [kJ/kg]
VOLUMEN
ESPECIFICO
*Volumen por unidad
de masa*
v = V / m [m3/kg]
INTENSIVAS
Propiedades independientes
de la masa
DENSIDAD
*Se define densidad a la
masa por unidad de volumen*
ρ = m / V [kg/m3]
PRESIÓN
Presion = Fuerza / Área
Pmanométrica = Pabs - Patm
Pvacío = Patm - Pabs
TEMPERATURA
T(K) = T (°C) + 273.15
T(R) = T (°F) + 450.67
T(R) = 1.8T (K)
T(°F) = 1.8T (°C) + 32
TIPOS DE SISTEMAS TERMODINÁMICOS
SISTEMA CERRADO
MASA CONTROL
(La masa no varía,
la masa es constante)
La energía si puede cruzar
puede atravesar la frontera.
Para su solución se emplean
balances de energía.
FRONTERA MOVIL
Qnetin - Wneout = ΔH
FRONTERA FIJA
Qnetin - Wneout = ΔU
SISTEMA ABIERTO
VOLUMEN CONTROL
(La masa varía)
Para solución de sistemas
abiertos se emplean:
BALANCE DE ENERGÍA
TASA DE ENERGIA POR
UNIDAD DE TIEMPO
E_dotin - E_dotout = dESIST/t
Ein - Eout = ΔESIST
BALANCE MASA
FLUJO MASICO
FLUJO VOLUMENTRICO
V_dot=ATVprom
m_dotin - m_dotout = dmSIST/t
m_dot = ρ*V_dot
min - mout = ΔmSIST
Topic principal