Sistemas Inorganicos II
Docente: Angela Leal
Karen Dayanna López Gaitán
Cod. 2015115024
Departamento: Lic. Química
Universidad Pedagógica Nacional
+
QUIMICA INORGANICA
Teorias
Teoría del enlace de Valencia
Enlace se forma
Superposición de
Orbitales Atómicos
Enlace sea mas fuerte
Enlace débil (π)
Enlace fuerte σ
Superposición de Orbitales Atómicos
Naturaleza del Enlace Quimíco
Disociación de las Moléculas
Homonucleares
No Polares
Distribución de carga electronica
simétrica
H2, O2 y N2
Diatomicas
Redes Cristalinas
solida
Ordenamiento y
Empequetamiento
Moléculas o iones
Teoría del Orbital Molecular
Especificar la
configuración
electrónica
Comportamiento
Ondulatorio
Pueden tener
los electrones
Geometría Molecular
Color
Complejos termocromicos
𝑨𝒈𝟐 (𝑯𝒈𝑰𝟒) -> 𝑨𝒈𝟐 (𝑯𝒈𝑰𝟒)
Amarillo - a - naranja
Compuesto
Color (reversible)
Cambios de Temperatura
Reactividad
Polaridad
Magnetismo
Disposición Tridimensional
de los Átomos
Hibridación
Disposición
de electrones
Formación de enlaces
Teoría de Enlaces de Valencia
Un Átomo se mezcla con
varios orbitales moleculares
Orbitales Hibridos
Formar
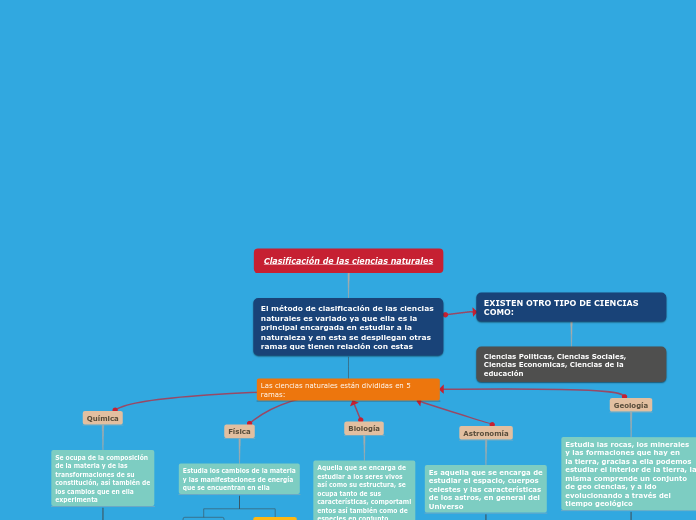
Compuestos Inorgánicos
Compuestos Terciarios
Sales Oxisales
Oxacidos
Hidróxidos Ácidos
Compuestos Binarios
Hidruros
Hidruros No Metálicos
Hidruros Metalicos
Sales
Sales Haloideas
Sales Pseudosales
Ácidos
Ácidos Hidracidos
Óxidos
Óxidos básicos
Óxidos Ácidos y
Peróxidos
Compuestos de coordinación
Indices de coordinación
Estereoquimica
Parámetros Electrónicos
Estabilidad
Configuracion d^n
Parámetros Estáticos
Repulsiones entre Ligandos
Compuesto del grupo P
VESPR
Estructuras Neutras
complejos
Ligando
Átomo donadorde pares e
Base de Lewis
Tipos de Ligando
Numero de Átomos donadores
Polidentados
Dos o más Átomos donadores
Puente
Unidos a dos o más metales
Quelatos
Unidos a un mismo Metal
Monodentados
Naturaleza de Átomos donadores
O,N, P, S ,Cl, Haluros ó C
Carga puntual
Modelo de Kepert
Àtomo central
Metal
Àcido de Lewis