door DIANA PROANIO 4 jaren geleden
924
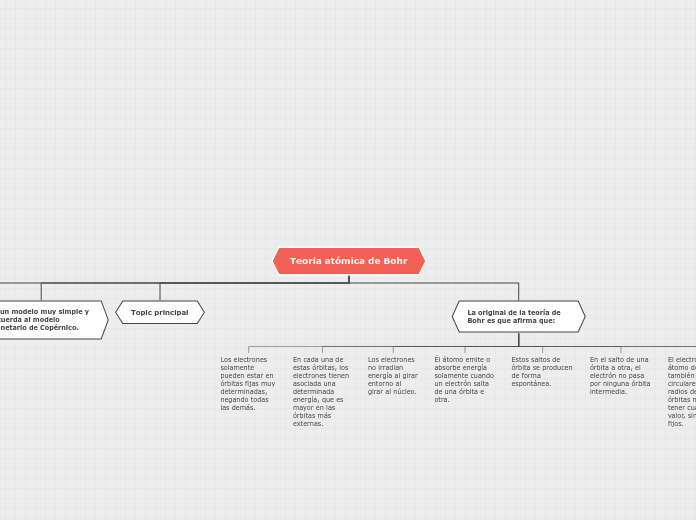
Teoría atómica de Bohr
La teoría atómica de Bohr se basa en los postulados de Plank sobre los cuantums, las menores unidades de energía que pueden transmitirse en cualquier longitud de onda. Bohr propone que los electrones giran alrededor del núcleo en órbitas fijas, cada una con una energía determinada, mayor en las órbitas más externas.