БИОЛОГИЯ И ХИМИЯ
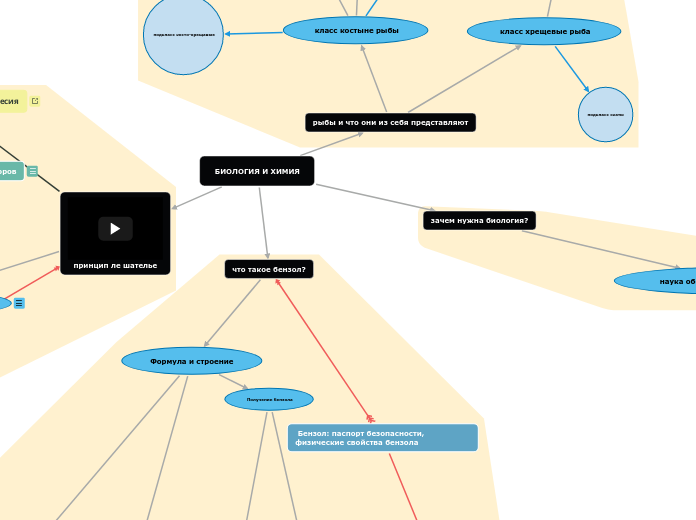
рыбы и что они из себя представляют
класс костыне рыбы
подкласс двоякодыщащие
подкласс косто-хрещавые
подкласс лучепёрные
подкласс кистепёрные
класс хрещевые рыба
подкласс скаты
подкласс акулы
зачем нужна биология?
наука обо всем живом в нашем мире
Польза биологии для студентов и преподавателей
Почему полезно учить биологию?
что такое бензол?
Формула и строение
Получение бензола
🙀
С момента открытия C6H6. прошло почти 200 лет. На протяжении десятилетий промышленники постоянно совершенствовали и совершенствуют реакции получения бензола, чтобы сделать производство экономически эффективным и производить как можно меньше токсичных отходов. Существуют различные технологии получения этого углеводорода. Среди прочего, он получается в результате:
- выделения бензольных колец из газовой смолы,
- реформирования (реформинга) сырой нефти,
- деалкилирования, т.е. удаления алкильной группы из некоторых ароматических углеводородов (например, толуола).
Следует помнить, что бензол является высокотоксичным веществом. В контролируемых условиях получение бензола, реакция реформинга или деалкилирования требует особых мер безопасности. А каковы физико-химические свойства бензола? Давайте проверим!
😼
☢️☣️
Как можно наиболее просто описать бензол?Молекулярная формула этого органического соединения такова: C6H6, а это означает, что на каждые 6 атомов углерода (C) в нем приходится 6 атомов водорода (H). Бензол, наряду с другими соединениями, такими как, например, нафталин, относится к группе ароматических углеводородов.
Чем еще отличается бензол? Строение его молекулы напоминает кольцо, что характерно для ароматических углеводородов. Если посмотрим на молекулу бензола, полуструктурную формулу или ее 3D-модель, мы заметим, что пропорциональные плечи кольца образуют взаимосвязанные одиночные атомы углерода и водорода.
Бензол: паспорт безопасности, физические свойства бензола
🎂🎂🎂🎂
Многие люди легко способны распознать бензол, поскольку запах этого соединения очень интенсивный и сладковатый, напоминающий запах пластмассы. Это прозрачная жидкость, нерастворимая или очень слабо растворимая в воде. К физическим свойствам бензола можно также добавить то, что он растворяется в производном метана — тетрахлорметане.
Что еще характерно для бензола? Температура кипения этой жидкости ниже, чем у воды, и составляет 80 °C. C6H6 также легко воспламеняется и очень быстро переходит из жидкого состояния в летучее (поэтому его следует хранить только в прохладном месте, вдали от солнечного света!) При комнатной температуре около 20 °C плотность бензола составляет 0,88 г/см3.
принцип ле шателье
Состояние химического равновесия
Может ли протекать реакция, является ли она обратимой или необратимой, во многом зависит от заданных условий процесса и его типа. Если происходит обратимая реакция, т.е. субстраты превращаются в продукты в результате химической реакции и в то же время субстраты восстанавливаются в результате столкновений между молекулами продуктов, то в какой-то момент времени в ходе этих реакций устанавливается состояние химического равновесия. Другими словами, можно сказать, что концентрации субстратов и продуктов в системе находятся на постоянном уровне — их количество не меняется, несмотря на непрерывное протекание реакции. При химическом равновесии скорости реакций в обоих направлениях одинаковы. Химическое равновесие при определенных условиях означает для данной системы состояние с наибольшей устойчивостью. При этом потребность в энергии низкая.
Обратимые и необратимые реакции
К необратимым реакциям относятся, прежде всего, все те, в которых образуются осадки. На практике они нерастворимы в воде и не могут быть восстановлены. Обратимость процесса также труднодостижима в случае реакций, протекающих в открытых системах, то есть, например, в химическом стакане или сферической колбе, из которой может свободно выходить один из образующихся продуктов, например, углекислый газ. Но изменив условия реакции, то есть переместив ее в закрытую систему, можно сделать ее обратимой. Кроме того, к группе необратимых реакций относятся все процессы, в которых взаимодействие между молекулами продуктов намного меньше, чем между субстратами. Поэтому такой процесс происходит в двух направлениях, но поскольку восстановление субстратов ничтожно мало, на практике ее классифицируют как необратимую реакцию
Это реакции, в которых из субстратов образуются продукты и в то же время со сравнимой интенсивностью происходит обратный процесс — восстановление субстратов из продуктов. В записи реакции, между реагентами помещают две стрелки, причем наконечники стрелок направлены в противоположные стороны, чтобы указать на обратимость происходящих реакций.
Обратимые реакции — это в основном реакции, протекающие в закрытых системах. Молекулы субстратов и продуктов не могут покинуть реакционную среду и сталкиваются друг с другом, образуя продукты и восстанавливая субстраты. В качестве примера такой реакции можно привести получение иодоводорода из иода и водорода.
влияет ряд факторов
На состояние химического равновесия влияет ряд факторов. Вот некоторые из них:
- Температура,
- объем реакционной системы,
- давление,
- концентрация реагентов.
Важно отметить, что на положение равновесного состояния не влияет добавление или изменение катализатора реакции. Его задача заключается лишь в том, чтобы сократить время, в течение которого достигается равновесие.
Смещение химического равновесия
Константа химического равновесия K
Константа химического равновесия K — это коэффициент, который описывает равновесие двух обратимых реакций. Он определяется как коэффициент произведений концентраций продуктов и субстрата, возведенных в степень в соответствии со стехиометрическими коэффициентами, которые были измерены при химическом равновесии. Формула для константы была сформулирована в 1864 году как так называемый закон действия масс. Обратите внимание, что эта величина зависит от конкретной реакции.