hauen artean gertatzen dira
Elementu bereko metalen atomoak
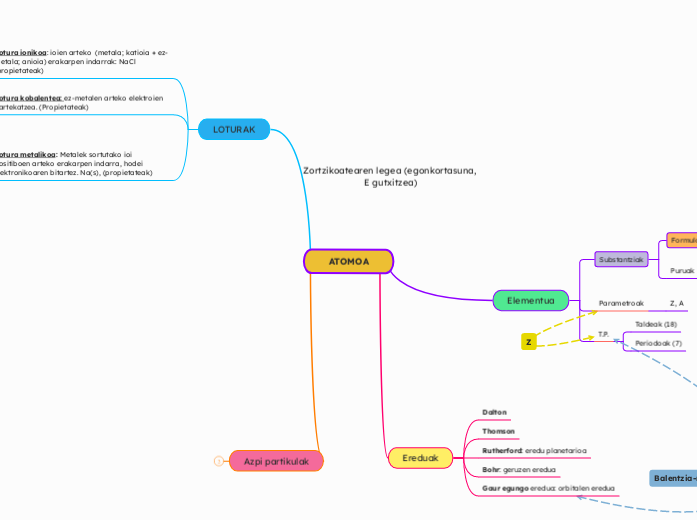
Sare (krital) metalikoak
Lotura metalikoa
Balentzia elektroiak
Elektroi-hodeiaren eredua
Subtema
Disdira metalikoa dute.
Disolbagarriezinak dira.
Eroankortasun elektriko handia dute.
Oso harikorrak eta xaflakorrak dira.
Fusio-tenpretura altua dute.
Dentsitate handia dute.
Ez mrtalak eta ez metalak
Kristal kobalenteak
Lotura kobalentea
Elektroien partekatzea
Elektroiak partekatzen dute, zortzikotearen araua betetzeko.
Lewis-en adierazpenarekin azaltzen da
Haien propietateak hauek dira
Ez dira elektrizitatearen eroale onak.
Oso gogorrak dira.
Fusio- eta irakite-tenperaturak altuak.
Molekulak
Metalak eta ez metalak
Sare (kristal) ionikoak
Lotura ionikoa
Elektroien transferentzia
Ioiak ala katioiak sortzen dute zortzikotearen araua betetzeko.
ionizazio erreakzioen bidez azaltzen da.
Haien propietateak hauek dira:
Solidoak dira.
Bakarrik likido egoeran elektrizitatearen eroaleak dira.
Konposatu ioniko asko disolbatzaile polarretan disolba daitezke.
Hauskorrak dira.
Kristal ionikoak gogorrak izaten dira.
Fusio- eta irakite-tenperaturak altual edo oso altuak dira.
Atomoen arteko loturak
Atomoen konfigurazio elektronikoa
Oro har, gas geldo baten konfigurazia hartzen dute.
Gas geldoen egonkortasuna lortzeko elektroiak galdu, hartu ala irabazi egiten dute, balentzia-geruza beteta izateko 8 elektroiekin.
Hori zortzikotearen araua da.