av Nevaeh Silver 1 år siden
214
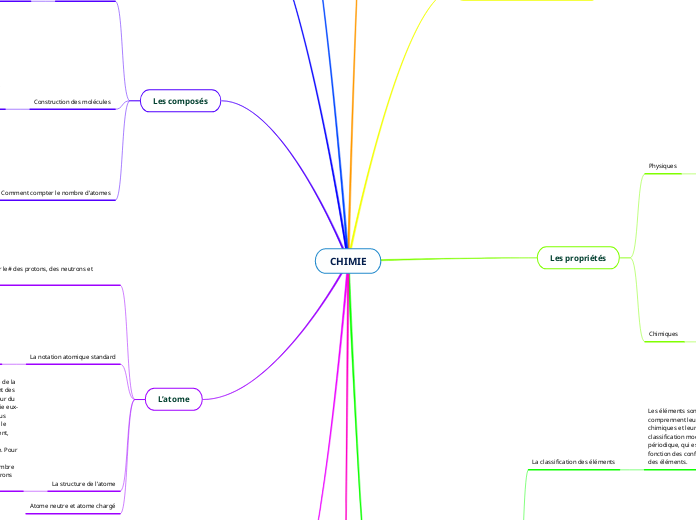
CHIMIE
La densité est une caractéristique physique qui représente la masse par unité de volume d'une substance, généralement exprimée en grammes par centimètre cube ou en kilogrammes par mètre cube.
av Nevaeh Silver 1 år siden
214

Mer som dette
Le numéro atomique (Z) est le nombre de protons dans le noyau d'un atome.
Le nombre de masse (A) est la somme du nombre de protons et de neutrons dans le noyau d'un atome.
Le nombre d'électrons dans un atome neutre est égal au nombre de protons
Les deux types de liaisons chimiques les plus courants sont les liaisons ioniques et les liaisons covalentes.
Des liaisons ionique
Des liaisons ioniques se produisent entre un métal et un non-métal. Dans une liaison ionique, un atome donne un ou plusieurs électrons à l'autre atome, ce qui donne un ion chargé positivement (cation) et un ion chargé négativement (anion). Ces ions s'attirent alors et forment une liaison ionique. Un exemple de composé ionique est le sel de table (NaCl), composé d'un ion sodium (Na+) et d'un ion chlorure (Cl-).
Des liaisons covalentes
Des liaisons covalentes se produisent entre deux non-métaux. Dans une liaison covalente, les atomes partagent un ou plusieurs électrons entre eux afin d'obtenir une configuration électronique stable. Un exemple de composé covalent est l'eau (H2O), qui est composée de deux atomes d'hydrogène et d'un atome d'oxygène qui partagent des électrons entre eux.
La formule de la densité est : Densité = Masse / Volume
Groups
Le tableau périodique est également organisé en colonnes appelées groupes, qui indiquent le nombre d'électrons de valence d'un atome. Les éléments du même groupe ont des propriétés chimiques et physiques similaires, et le nombre d'électrons de valence détermine la façon dont un atome réagira chimiquement avec d'autres atomes.
Périodes
Le tableau périodique est organisé en lignes appelées périodes, qui indiquent le nombre de couches d'électrons qu'un atome possède. Les éléments de la même période ont le même nombre de couches d'électrons et le nombre d'électrons dans la couche la plus externe (appelée couche de valence) augmente de gauche à droite tout au long de la période.
Electrons de valance
Les électrons de valence sont les électrons de la coque la plus externe d'un atome. Ces électrons sont impliqués dans des réactions chimiques et déterminent les propriétés chimiques d'un élément. Les éléments d'un même groupe ont le même nombre d'électrons de valence, c'est pourquoi ils ont des propriétés chimiques similaires.
Métaux alcalins
Ce sont des métaux très réactifs avec des points de fusion bas. Ils perdent facilement un électron pour former des ions chargés positivement. Les exemples incluent le lithium, le sodium et le potassium.
Métaux alcalino-terreux
Ces métaux sont moins réactifs que les métaux alcalins. Ils ont des points de fusion plus élevés et forment des ions 2+. Les exemples incluent le magnésium, le calcium et le strontium.
Halogènes
Ces non-métaux sont très réactifs et possèdent 7 électrons de valence. Ils gagnent facilement un électron pour former des ions chargés négativement. Les exemples incluent le chlore, le fluor et l'iode.
Gaz nobles
ces non-métaux ne sont pas réactifs et ont des couches d'électrons externes complètes. Les exemples incluent l'hélium, le néon et l'argon.
Métaux de transition
Ces métaux sont moins réactifs que les métaux alcalins et alcalino-terreux. Ils ont plusieurs électrons de valence et forment des composés colorés. Les exemples incluent le fer, le cuivre et l'or.
Métaux de terres rares
Ces métaux ont des propriétés uniques et sont utilisés dans la technologie et la médecine. Les exemples incluent l'uranium, le plutonium et le néodyme.
Un non-métal
Les non-métaux sont des matériaux naturels qui ne produisent ni chaleur ni électricité EX. hélium
Un métalloïde
Un métalloïde est un élément qui possède des propriétés intermédiaires entre celles des métaux et des non-métaux. EX. Silicium
Un métal
Un métal est un élément qui forme des ions positifs et possède des liaisons métalliques. EX. Nickel
Stabilité
La capacité d'une substance à maintenir sa composition chimique et ses propriétés dans le temps et dans différentes conditions
Corrosion
La capacité d'une substance à se détériorer ou à se dissoudre lorsqu'elle est exposée à certains matériaux ou environnements
Toxicité
La capacité d'une substance à nuire ou à causer des dommages aux organismes vivants
Couleur
Texture
Conductivité
Viscosité
Dureté
Magnétisme
Solubilité
Point de fusion
Point d'ébullition
Densité
Une substance pure est une substance composée d'un seul type de particule, soit un atome, soit une molécule.
Èléments
Un élément est une substance qui ne peut pas être décomposée en substances plus simples par des moyens chimiques et qui est constituée d'un seul type d'atome.
Composés
Un composé est composé de deux ou plusieurs types d'atomes différents qui sont chimiquement liés ensemble.
Un mélange est une substance composée d'au moins deux types de particules différentes qui sont physiquement combinées, mais non liées chimiquement.
Hétérogène
Les particules du mélange hétérogène ne sont pas uniformément réparties.
Homogène
Un mélange homogène contient des particules uniformément réparties.