av Digital Solutions 1 år siden
119
GASES
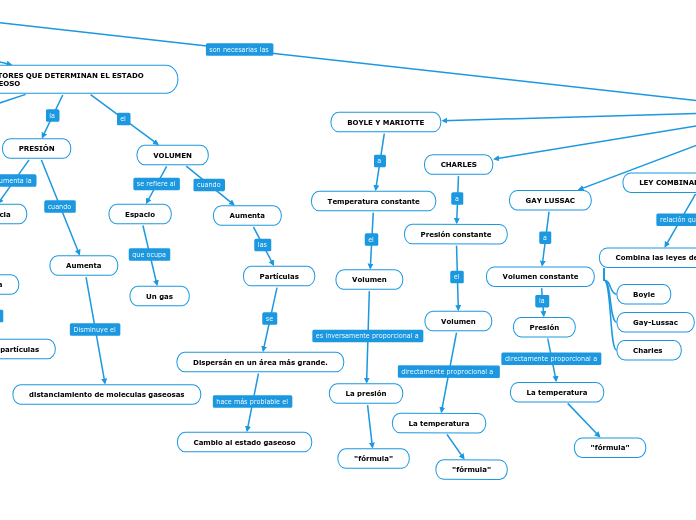
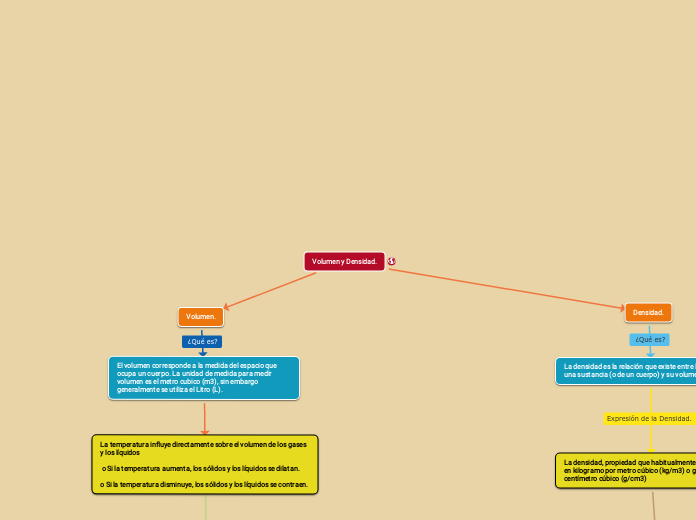
Las leyes de los gases describen cómo varían las propiedades de los gases bajo diferentes condiciones. La ley de Charles establece que, a presión constante, el volumen de un gas es directamente proporcional a su temperatura.