IMMUNODEFICIENZE
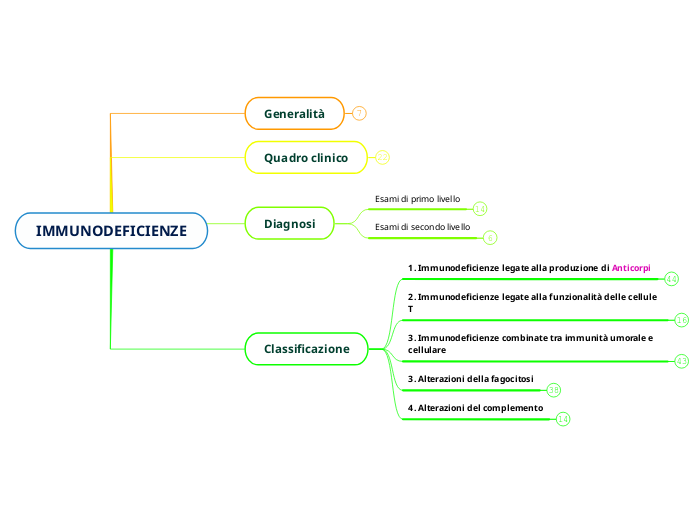
Classificazione
4. Alterazioni del complemento
Terapia
supportare l’attività di risposta contro le infezioni con le specifiche terapie antimicrobiche (detto dal prof) e inoltre, quando è necessario, intervenire anche con farmaci più specifici che riguardano il controllo degli effetti collaterali della mancanza del complemento stesso (es. angioedema ereditario).
Nella diagnosi bisogna fare attenzione, in quanto il test per dosare il C1 inibitore può essere qualitativo o quantitativo ma non tutti i laboratori li fanno entrambi
ci può essere il paziente che ne produce una quantità adeguata ma non funziona o quello che ne produce proprio poco, quindi l’ideale è fare contemporaneamente entrambi i test.
In particolare, è importate citare il deficit del fattore C1 inibitore che può predisporre il paziente non ad una
immunodeficienza ma ad angioedema ereditario
quindi presenterà labbra gonfie, orecchie gonfie, palpebre gonfie senza un apparente motivo, in modo ricorrente, non avendo un deficit del sistema immunitario, ma ha un deficit talmente specifico che gli dà solamente quei problem
Le infezioni connesse a deficit del complemento sono prevalentemente di tipo batterico, in particolare Meningococco e Pneumococco.
Le proteine del complemento misurate più frequentemente sono la C3 e la C4. Nel caso in cui il clinico sospetti la presenza di un difetto non evidenziabile con la misura del C3 e del C4, può essere misurata l’attività totale del complemento (CH50)
Il CH50 misura la funzionalità completa della via classica di attivazione del complemento C1-C9
CH50 è un test che indica un’alterazione funzionale senza però specificare quale sia la proteina del complemento responsabile dell’alterazione.
La cascata del complemento può essere attivata tramite la via classica (anticorpi), la via alternativa (endotossine) e tramite la via delle lectine.
Sono più spesso secondarie e si trovano associate ad altre patologie, soprattutto quelle con eccesso di immunocomplessi.
3. Alterazioni della fagocitosi
• Malattia granulomatosa cronica
I pazienti devono essere sottoposti a profilassi per os con trimetoprim/sulfametossazolo, per ridurre le infezioni batteriche (in particolare S. aureus)
il trapianto di cellule staminali ematopoietiche è l’unica terapia possibile per la malattia granulomatosa cronica.
il test fondamentale è quello alla diidrorodamina, che misura la produzione dei radicali liberi dell’ossigeno. Il nitroblu di tetrazolio può essere utilizzato, ma ormai è quasi del tutto soppiantato dalla diidrorodamina.
viene sospettata clinicamente e tramite analisi di laboratorio che testimoniano il deficit microbicida;
Caratteristiche cliniche
- Infezioni gravi e ricorrenti
- Ascessi freddi (granulomi)
Gli ascessi freddi sono chiamati così perché non comportano alcuna reazione infiammatoria e non evolvono mai verso la guarigione. La formazione di tanti ascessi porta alla ridotta funzionalità del viscere interessato e quelli a livello intestinale entrano in diagnosi differenziale con la malattia di Crohn.
Sono la manifestazione tipica. L’ascesso rappresenta una raccolta di neutrofili, i quali raggiungono il sito interessato, ma non sono in grado di esercitare la loro funzione, in quanto non innescano i processi secondari alla loro attivazione.
- Ritardo nella caduta del cordone ombelicale: prima manifestazione nel periodo dell’infanzia.
Normalmente il cordone cade ad opera dei granulociti neutrofili e poi dei monociti macrofagi. Per cui, se un neonato non presenta la caduta del cordone ombelicale, ciò rappresenta un campanello d’allarme.
Se il soggetto presenta una mutazione dell’enzima NADPH, ha di conseguenza una ridotta attivazione del burst respiratorio e quindi una ridotta produzione di anione superossido
La causa prevede delle mutazioni in uno dei 5 geni che codificano le subunità della nicotinamide adenina dinucleotide fosfato (NADPH) ossidasi fagocitica.
• Deficit di mieloperossidasi
Molto spesso si associa a candidiasi disseminate gravissime che a volte si sovrappongono a diabete mellito; → ancora una volta vengono colpiti contemporaneamente sistema endocrino e sistema immunitario → risulta pertanto essere una condizione che necessita in teoria di un intervento massiccio come il trapianto di cellule staminali, che può essere risolutivo.
In questo caso non c'è una terapia specifica, quindi purtroppo non si può far altro che supportare il paziente in base a quelle che sono le sue esigenze specifiche + profilassi antifungina.
Rimaniamo sempre nell'ambito di deficit di degranulazione di macrofagi, di distruzione di agenti.
• Sindrome di chediak higashi
- Alte dosi di acido ascorbico, anche se non ha un ruolo risolutivo: sembra avere un’efficacia nel migliorare la capacità dei neutrofili di degranulare, anche se non ha un ruolo risolutivo. Ci sono controversie circa la sua efficacia, ma essendo una vitamina che non ha effetti collaterali viene ugualmente somministrata in cronico
- Profilassi antibiotica
- Trapianto di cellule staminali → se non eseguito il paziente muore entro il settimo anno di età
Test genetici
– Albinismo oculocutaneo → capelli color argento e fotosensibilità solare molto accentuata.
– Predisposizione a eventi infettivi (soprattutto respiratori) – Lieve deficit della coagulazione
– Possibili anomalie neurologiche, come l’atassia, che però compaiono più tardivamente (in adolescenza) e diventano predominanti nel quadro clinico
– Possibile esordio accelerato con febbre ittero, epatosplenomegalia, diatesi emorragica (morte sopraggiunge in 30 mesi in questi casi)
L’alterazione del lisosoma ne rende impossibile la fusione con il fagosoma rendendo così inefficace la fagocitosi
Sindrome rara a trasmissione autosomica recessiva dovuta alla mutazione del gene LYST, un gene lisosomiale.
• Deficit di adesione leucocitaria (LAD)
Trattamento → trapianto di cellule staminali.
I neutrofili saranno numericamente normali come le Ig e le sottopopolazioni linfocitarie. Saranno quindi necessari test di secondo livello con l’utilizzo di Ab monoclonali rivolti verso proteine di superfice necessarie all’adesione (es. MAb anti-CD18).
Caratteristiche
I sintomi insorgono durante l’infanzia con infezioni
ricorrenti o progressive necrotizzanti della cute, delle vie
respiratorie, del tratto GI e delle mucose genitali,
causate da stafilococchi e da microrganismi Gram negativi, periodontite, scarsa cicatrizzazione delle ferite.
Abbiamo dei neutrofili sostanzialmente normali, ma che non sono in grado di aderire all'endotelio, rendendoli così non funzionali ed aumentando la suscettibilità a infezioni batteriche e fungine.
Caratteristica tipica dei deficit di adesione è la presenza in anamnesi di ritardato distacco del cordone ombelicale (oltre le 3 settimane), con associazione molto spesso di infezioni localizzate al sito di separazione.
Sono disordini AR, distintI in:
LAD 1 → deficit β2 integrina
LAD 2 → assenza dei ligandi per le selectine
LAD 3 → attivazione difettosa delle integrine
3. Immunodeficienze combinate tra immunità umorale e cellulare
• SINDROME IPEX (immune-dysregulation, polyendrocrinopathy, enteropathy, x-linked)
Trattamento
Si può utilizzare il trapianto di cellule staminali che in questo caso è l'unica possibilità per far sopravvivere il bambino.
Agenti immunosoppressori come ciclosporina, tacrolimus, sirolimus associate ad ampie dosi di steroidi.
Quando si supera la fase iniziale e si riesce a controllare l’infezione nei primi giorni di vita, si possono associare delle degenerazioni di tipo autoimmunitario perché FOXP3 regola anche la tolleranza immunologica
Tale mutazione genera una disfunzione delle cellule T che comporterà infezioni talmente gravi da portare il bambino a morte in pochi giorni, il quale appena nato viene colpito da una diarrea sanguinolenta gravissima e non c’è sostanzialmente neanche il tempo di intervenire.
Patologia molto rara quanto grave. È una sindrome dovuta alla mutazione del gene FOXP3, un gene regolatore del sistema immunitario codificato sul cromosoma X.
• Atassia teleangectasica
atassia cerebellare progressiva
teleangectasie oculocutanee (sono evidenti nella congiuntiva bulbare, orecchie e ai lati del collo) infezioni polmonari ricorrenti (polmoniti ricorrenti, bronchiectasie...)
sintomi endocrini (rari → atrofia testicolare, diabete mellito)
Patologia estremamente grave a trasmissione AR. Deriva da mutazioni del gene ATM (cromosoma 11) codifica per una proteina coinvolta nella riparazione del DNA. Si sviluppa un’immunodeficienza con deficit sia cellulare (deficit progressivo dei linfociti T) che umorale (deficit di immunoglobuline tra cui le IgA, le IgE e le IgG).
• Sindrome di Wiskott-Aldrich
La prognosi è severa: la sopravvivenza in età adolescenziale è rara e la morte avviene per infezioni gravi, sanguinamenti massivi oppure linfomi associati all’EBV.
- Supporto con Ig, antibiotici e antivirali (vaccini con virus uccisi)
- Trasfusione piastrinica (nei casi più gravi), in caso splenectomia
- Trattamento delle problematiche secondarie (soprattutto dermatite atopica che espone il derma alle infezioni esterne)
- Trapianto cellule staminali ematopoietiche
- Conta e funzione linfociti T diminuita
- Elevati livelli di IgE e IgA
- Bassi livelli di IgM, bassi o normali di IgG
- Ridotta attività delle NK
- Chemiotassi neutrofila alterata
È una sindrome specifica associata a deficit dell’immunità umorale o cellulare associati (deficit combinato).
Si sviluppano così cellule non funzionali che vanno incontro a eliminazione con:
- sanguinamenti spontanei (spesso diarrea ematica) → Riduzione piastrinica con piastrine di ridotte dimensioni
- Infezioni respiratorie ricorrenti → Deplezione di cellule immunitarie
- Eczema (dermatite atopica severa)
- Neoplasia (soprattutto leucemia linfatica acuta e linfomi)
Sindrome causata dall'alterazione di un gene noto come WASP (Wiskott-Aldrich Syndrome Protein): codifica per una proteina necessaria alla costruzione del citoscheletro (in particolare, dei filamenti di actina) delle cellule prodotte dal sistema ematopoietico
• Sindrome da iper IgE (o s. Di Giobbe)
Prevede il trapianto di midollo osseo (è molto importante che venga fatto il prima possibile). Nell’attesa, si
può procedere con terapia di supporto di Ig quando viene dimostrato che le altre classi sono carenti. Fondamentale è anche il trattamento antibiotico della dermatite atopica.
È importante fare la diagnosi differenziale tra le due forme perché incide sulla prognosi:
– la mortalità per il gene STAT3 di solito è in età adulta, quindi è un quadro più gestibile;
– la mutazione per il DOC8 è sicuramente più severa e può portare a morte anche in età infantile.
Si basa sulla valutazione dei livelli sierici di IgE che per fare diagnosi devono essere >2000 IU/mL in associazione a deficit dell’immunità umorale e cellulare, indagati con test di stimolazione linfocitaria
Manifestazioni cliniche
Tratti facciali grossolani
Eliminazione ritardata dei denti da latte -
Osteopenia e fratture ricorrenti
Se ne conoscono due forme
- Autosomica recessiva (mutazioni del gene DOC8) In questo caso è molto più comune la ricorrenza di patologie neoplastiche; la tipologia delle infezioni è soprattutto di tipo virale o parassitaria.
- Autosomica dominante (mutazioni del gene STAT3) Caratterizzata prevalentemente da infezioni di tipo batterico, con ascessi ricorrenti da S. Aureus, o fungine (es. Aspergillus). Tipiche sono le alterazioni di tipo muscolo scheletrico, non presenti nell'autosomica recessiva.
Immunodeficienza ereditaria combinata dei linfociti B e T caratterizzata da ascessi stafilococcici ricorrenti a carico di cute, polmoni, articolazioni e organi interni associati a infezioni sinopolmonari e grave dermatite eosinofila pruriginosa può associarsi ad altre manifestazioni di tipo allergico (es. allergie alimentari).
• Immunodeficienza combinata B-cell e T-cell (o SCID, immunodeficienza severa combinata)
Questi pazienti necessitano di trapianto di cellule staminali o in alcuni quando è possibile di una gene therapy che vada proprio a risolvere il problema specifico.
Caratteristiche tipiche
- timo molto piccolo
- iposviluppo dei tessuti molli secondari (tonsille, linfonodi, placche del Peyer).
La causa più frequente di SCID a trasmissione AR è il deficit dell’enzima ADA (adenosin deaminasi) enzima fondamentale per la maturazione del precursore linfocitario non ancora orientato verso la forma B o T.
È presente un difetto di differenziazione dei linfociti T (che a volte si può associare ad un difetto di maturazione dei linfociti B) dato da mutazioni dei geni coinvolti nelle diverse fasi dello sviluppo dei linfociti.
Quando lo sviluppo dei linfociti B non è compromesso, il difetto dell’immunità umorale è dato dall’assenza della funzione helper dei linfociti T.
La SCID rappresenta la più importante e la più severa immunodeficienza combinata; è causata da diverse mutazioni di geni che portano all’assenza di tutta l’immunità umorale, cellulare di tipo adattativo e all’assenza di cellule NK
- Combinate In quanto riguardano sia il compartimento cellulare che umorale → se è alterato il linfocita sarà alterata anche la produzione di Ig.
- Severe In quanto sono gravi, infatti si manifestano dall’inizio della vita e portano spesso il paziente a morte per complicanze infettive e/o tumorali
2. Immunodeficienze legate alla funzionalità delle cellule T
• Poliendocrinopatia autoimmune (APECED)
È un paziente molto complesso e delicato che necessita soprattutto di una stabilizzazione endocrinologica perché può scompensarsi molto facilmente, può avere anche delle diarree muco-ematiche gravissime che possono portarlo all’exitus.
- Esordio con candidiasi orale, genitale e ungueale
- Ipoparatiroidismo (segno endocrino più comune)
- Insufficienza surrenalica
- Patologie autoimmunitarie, quali tiroidite, ipofisite, S. di Sjogren e diabete mellito di tipo 1 (sono molto
rari)
A livello patogenetico è dovuta a mutazioni del gene AIRE (21q22.3) che codifica per il fattore di trascrizione AIRE coinvolto nei meccanismi di tolleranza immunologica e contribuisce alla selezione dei cloni T auotreattivi nel timo e linfonodi
È una malattia genetica (trasmissione AR) ad esordio pediatrico in combinazione con una candidiasi cronica,
ipoparatiroidismo e insufficienza autoimmune surrenalica (M. di Harrison).
• Sindrome di Digeorge
Trattamento
- Sindrome parziale: integratori di Ca e vitamina D
- Sindrome totale: trapianto di tessuto timico (ma si può fare solo in pochi casi) o cellule staminali
ematopoietiche coltivate
La prognosi spesso dipende dalla gravità della cardiopatia. Il follow-up di questi pazienti non si può mai interrompere.
Diagnosi
1. Valutazione della funzione immunitaria con livelli di immunoglobulina (Ig), titolazione dei vaccinici,
e conta delle sottopopolazioni linfocitarie
2. Valutazione della funzione paratiroidea (vedi Ipocalcemia)
3. Analisi cromosomica
Questo tipo di condizione si associa anche ad alterazioni di tipo morfologico del paziente: presentano una facies con impianto molto basso delle orecchie, schisi facciale sulla linea mediana, ipoplasia e retrazione della mandibola, ipertelorismo e filtro nasale corto.
→ Caratteristica fondamentale di tali pazienti è l’ipoplasia o aplasia timica e delle paratiroidi con conseguenti deficit dei linfociti T e ipoparatiroidismo.
Infezioni ricorrenti iniziano poco dopo la nascita, ma il grado di immunodeficienza varia notevolmente e la funzionalità dei linfociti T può migliorare spontaneamente
La sindrome di DiGeorge è un'immunodeficienza primitiva con difetti delle cellule T. Deriva da delezioni geniche a livello del cromosoma 22
1. Immunodeficienze legate alla produzione di Anticorpi
• Sindrome da iper-IgM
Il trattamento prevede terapia sostitutiva di Ig e.v. o s.c., profilassi e terapia antibiotica e, se possibile,
trapianto di cellule staminali (unico risolutivo) ematopoietiche per le forme XLP e CD40L.
La diagnosi viene fatta valutando i livelli delle Ig presenti nel sangue ed effettuando test genetici.
Questo tipo di paziente è molto delicato perché le IgM spesso non sono funzionali, ma soprattutto non ha anticorpi della memoria, anticorpi mucosali e nemmeno anticorpi contro i parassiti. I bambini presentano sinusiti e infezioni polmonari frequenti.
Si caratterizza per un normale o addirittura elevato quantitativo di IgM nel sangue associato però ad un basso o assente valore di IgG, IgA o IgE.
Se ci sono delle alterazioni geniche che non permettono lo shift da IgM alle altre classi, avremo una iperproduzione di IgM e una ipoproduzione delle altre.
• Deficit selettivo di IgA
Diagnosi clinica
La diagnosi di deficit selettivo di IgA viene sospettata in pazienti che hanno infezioni ricorrenti (tra cui la giardiasi), reazioni trasfusionali anafilattiche, o una storia familiare di immunodeficienza comune variabile o malattie autoimmuni.
Diagnosi di laboratorio
- si ha una riduzione assoluta dei livelli sierici di IgA, diagnostica per la patologia quando il valore è al di sotto di 10 mg/dl
- le altre classi di Ig sono normali
- i linfociti B sono in numero normale
Segni e sintomi
Caratteristica di questa condizione sono le infezioni mucosali ricorrenti → la maggior parte dei pazienti non sanno di avere la patologia, si fanno semplicemente dei raffreddori ricorrenti o infezioni ricorrenti delle vie urinarie.
Il deficit selettivo di IgA è la seconda immunodeficienza più frequente in assoluto dopo CVID (circa lo 0.33% della popolazione).
• Immunodeficienza comune variabile (CVID)
→ Rispetto all’agammaglobulinemia di Bruton:
- Condizioni associate come acloridia e disturbi gastrici, talvolta anche malattia celiaca.
- Talvolta è presente splenomegalia per aumento dell’attività emocateretica
- Si possono avere tonsille ingrandite
- È caratterizzata da quadri molto più lievi ed un esordio più tardivo
- Presenza di normali linf B circolanti
CVID si associa a enteropatia autoimmune del piccolo intestino (sprue-like enteropathy) con iperplasia follicolare linfoide e quindi si associa a celiachia come causa di malassorbimento.
Condizioni diagnostiche
- Risposta vaccinale assente ad un tossoide difterico o tetanico
È un test diagnostico molto semplice che si usa SOLO in caso di sospetta immunodeficienza del sistema acquisito, quando il dosaggio sierico delle Ig è dubbio.
- Ig ridotte o assenti e all’elettroforesi
un’ipogammaglobulinemia ma in circolo si riscontrano i linfociti B in numero normale (a differenza della malattia di Bruton)
Già nello stato pre-B, il linfocita è maturo per esser messo in circolo, ma per produrre Ig, dopo stimolo antigenico, deve permettere la cooperazione del T-helper, che può avvenire attraverso l’interazione di due recettori:
Una mutazione di CD40L (su linfocita T) non permette una corretta cooperazione B-T e quindi non permette al linfocita B di continuare il processo di maturazione.
CD40 (su linfocita B)
CD40L (su linfocita T)
È anch’essa caratterizzata dall’assenza di anticorpi o da bassi valori di essi; è dovuta a mutazioni diverse da quella del BTK, tra le quali la mutazione del CD40L è quella più frequente.
• SINDROME DI BRUTON
Le complicanze infettive dell’agammaglobulinemia possono essere controllate dall’infusione periodica (settimanale o mensile) di γ-globuline
Questa strategia permette di fornire al paziente anticorpi preformati rivolti verso gli antigeni più comuni e conferiscono al paziente un’efficace immunità passiva.
La sintomatologia esordisce presto, intorno ai primi 6-9 mesi di vita. Il paziente è soggetto ad infezioni prevalentemente di natura batterica spesso delle alte vie respiratorie (otiti e sinusiti ricorrenti talvolta molto gravi, specialmente nei primi mesi ) e altre infezioni da organismi extracellulari piogenici come lo Streptococcus Pneumoniae e l'Heamophilus Influenzae (polmoniti importanti resistenti a terapia e meningiti). È necessaria quindi la terapia antibiotica di profilassi.
I pazienti affetti da agammaglobulinemia presentano:
- Nei tessuti →assenza di plasmacellule.
- Nei linfonodi →mancato sviluppo dei centri germinativi
- Nel siero →completa assenza di linfociti B e di γ-globuline
a carico del compartimento B e quindi delle Ig (componente umorale), causata da mutazioni o delezioni del gene codificante (localizzato sul braccio lungo del cromosoma X) per un enzima noto come tirosinchinasi di Bruton (BTK) che comporta un arresto nella differenziazione dei linfociti B nel midollo osseo, nello stato di Pre-B
Agammaglobulinemia x-linked
Ci sono diversi difetti a livello del DNA che possono causare un problema nella produzione degli anticorpi: alcune mutazioni sono di tipo autosomico altre di tipo sessuale.
Diagnosi
Esami di secondo livello
→ Autoanticorpi
In particolare, nei difetti umorali, come deficit di IgA e CVID, caratterizzati da particolare frequenza di fenomeni autoimmuni, può essere necessario effettuare controlli del pannello autoanticorpale.
→ Il CH50
Un test funzionale dell’attività del complemento
→ Test diidrorodamina (test quantitativo) utilizzato per saggiare la capacità del macrofago di scatenare la risposta di radicali liberi dell’ossigeno
→ Respiratory Burst Assay (ovvero il burst respiratorio)
→ Sottopopolazioni linfocitarie
In base ai clusters di differenziazione (i cosiddetti “CD”) possiamo sapere quante sono le NK, i CD8, i
CD4.
→ Dosaggio Ig specifiche nella CVID per esempio si utilizza il vaccino antitetanico per valutare la risposta anticorpale.
Esami di primo livello
→ Dosaggio immunoglobulinico
→ Valutazione Ig specifiche
Nei confronti di Ag vaccinali (per valutare quindi anche la risposta ai vaccini) o se si è stati contagiati da patogeni noti.
→ SVP
Per valutare alcune possibili alterazioni come ad esempio la presenza dei corpi Howell-Jolly che può essere correlata a disturbi a livello splenico
→ Esame emocromocitometrico
L’alterazione delle sottopopolazioni o dell’attivazione linfocitaria può indirizzare verso un’alterazione del numero o della funzione.
A quel punto si passa all’indagine genetica molecolare che permette l’identificazione della mutazione.
In caso di linfopenia si procede alla fenotipizzazione dei linfociti eventualmente associate ad un test di stimolazione dei linfociti: esame di II/III livello che consiste nel stimolare i linfociti T o B con mitogeni aspecifici o specifici.
LUC (Large Uncolored Cells)
È possibile trovare un livello di LUC molto elevato anche in alcune infezioni gravi per esempio l’EBV, proprio perché il turnover velocizzato dalla presenza del virus dà delle forme atipiche di linfociti che la macchina conta e dà un valore molto elevato
cioè la percentuale di linfociti atipici.
La conta leucocitaria nei bambini presenta una differenza sostanziale rispetto all’individuo adulto.
I livelli di linfociti variano infatti nel corso della crescita; quindi, davanti a un quadro di linfopenia bisogna tenere sempre in considerazione che uno stesso valore può essere associato a una linfopenia lieve o a una condizione normale in base all’età del soggetto.
Possiamo avere una fisiologica inversione di formula (L > N), con una normale conta linfocitaria tra i 4000 e i 15000, fino ai 12-13 aa di età, momento in cui tende ad assumere i caratteri dell’adulto
Particolare attenzione alla conta dei GB, piastrine e distribuzione GR.
Quadro clinico
Le immunodeficienze possono presentarsi in tutte le fasce d’età ma più si presentano presto più sono dei difetti sistemici che sono molto a monte di quella che è la cascata immunologica del paziente e danno quadri molto più gravi
In ambito pediatrico, possono si suddividono in 3 fasce d’età:
• da 0 a 6 mesi
• da 6 mesi a 5 anni
• oltre i 5 anni
→ Tutti questi possibili segni e sintomi, associati al discorso di ammalarsi spesso, devono far pensare ad una immunodeficienza.
Caratteristiche presenti solo occasionalmente
• Disturbi della coagulazione
• Patologie autoimmunitarie
• Reazioni avverse a vaccini Non spiegabili in altro modo
• Infezioni da virus specifici
In particolare, l’EBV e CMV, che non riescono ad essere superate da parte del paziente
Sintomi o segni meno presenti
• Scarsa crescita e perdita di peso
• Disordini del sistema emopoietico
• Malassorbimento o diarree profuse
• Bronchiectasie
• Mastoiditi e sinusiti persistenti (non sono infezioni tipiche dell’infanzia)
Alterazioni più frequenti
• Assenza o riduzione di volume dei linfonodi e delle tonsille
I linfonodi, specialmente a livello latero-cervicale, sono normalmente quasi sempre palpabili in un bambino, al contrario in un paziente con immunodeficienza questo tipo di segno è particolarmente assente.
• Risposta parziale/mancata alla terapia antimicrobica
• Infezioni ricorrenti
Generalmente delle alte vie respiratorie, associate a infezioni che non sono di natura virale ma molto spesso di natura batterica e di grado severo (ricorrenza, gravità, persistenza ed eziologia dell’infezione devono essere indagate)
Generalità
Tipi di immunodeficienza
• Secondaria
Disturbi che si sviluppano più tardivamente e si associano a condizioni patologiche, per esempio, come la sindrome nefrosica o all’utilizzo di farmaci come i chemioterapici.
• Primaria
Questi disturbi sono generalmente presenti alla nascita; si tratta di disturbi genetici che sono solitamente di tipo ereditario. Si manifestano generalmente durante la prima o la seconda infanzia. Tuttavia, alcuni disturbi da immunodeficienza primaria (come l’immunodeficienza comune variabile) non vengono riconosciuti fino all’età adulta.
La maggior parte delle immunodeficienze viene diagnosticata in età pediatrica.
Le immunodeficienze primitive (IDP) rappresentano un gruppo eterogeneo di disturbi del sistema immunitario che predispongono alle infezioni, a una immunodisregolazione che si esprime con autoimmunità o autoinfiammazione e predisposizione allo sviluppo di neoplasie.