KJEMI
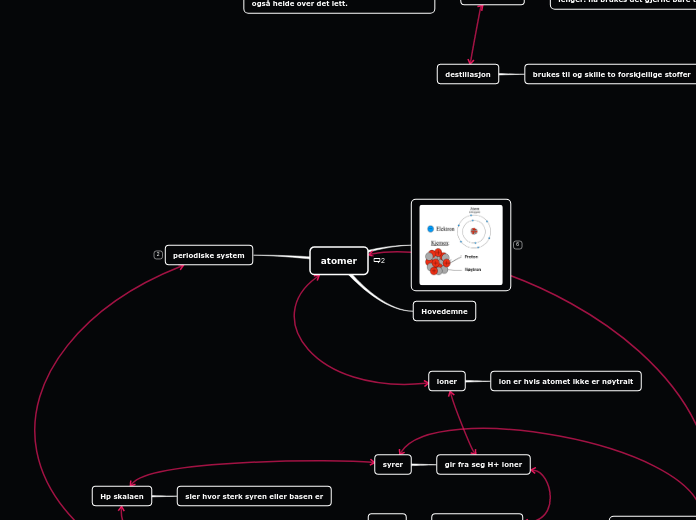
Atomer
Elektroner: negative, masse 0u
Protoner: positive, masse 1u
Nøytroner: nøytrale, masse 1u
Alle atomer vil ha fullt ytterskall
Bindinger
Metallbinding
Metallatomene i metallbinding har frie elektroner i ytterste skal. Elektronene beveger seg fritt mellom atomene.
Metallene leder da elektrisk strøm siden elektroner kan bevege seg fritt fra atom til atom gjennom metallet.
Ionebinding
Atomer gir fra seg og tar i mot elektroner og blir ioner.
Positive og negative ioner tiltrekker hverandre --> ionebinding.
Stoffer bygd opp med ionebinding = salter
Redoksreaksjoner
Elektronoverføring = redoksreaksjon
Et stoff oksideres og et stoff reduseres
Elektrokjemiske reaksjoner
- Redoksreaksjoner
- Elektrisk strøm tilføres for å få en reaksjon til å skje, eller det er en kjemisk reaksjon som produserer elektrisk energi
- Reduksjon og oksidasjon skjer forskjellige steder
Galvanisk element
Galvanisk element:
Elektrode og metallioner fra et metall høyt oppe i spenningsrekka på ene siden og elektrode og metallioner fra et metall lengre ned i spenningsrekka på andre siden.
Strøm (elektroner) går fra elektroden til metallet høyt oppe i spenningsrekka til ionene til metallet lengre ned på spenningsrekka.
Spenningsrekka
Elektrolyse
Elektrolyse
- Tilfører elektrisk strøm
- Løsning eller smeltet stoff
- Ioner --> atomer
Oksidasjon: gi fra seg elektroner
Reduksjon: ta i mot elektroner
Elektronparbinding
Deler elektronpar --> elektronparbinding
Atomer bundet sammen med elektronparbinding --> molekyler
Isotoper
Forskjellige varianter av samme grunnstoff (samme antall protoner i kjernen), men antall nøytroner er forskjellig
Skallmodell
Skall 3: 8 elektroner (18)
Skall 2: 8 elektroner
Skall 1: 2 elektroner
Periodesystem
Grunnstoff
Rent stoff
Samme atomnummer=
samme antall protoner i kjernen
Underemne