av Stephanie Melendez Suarez 5 år siden
1589
Las soluciones
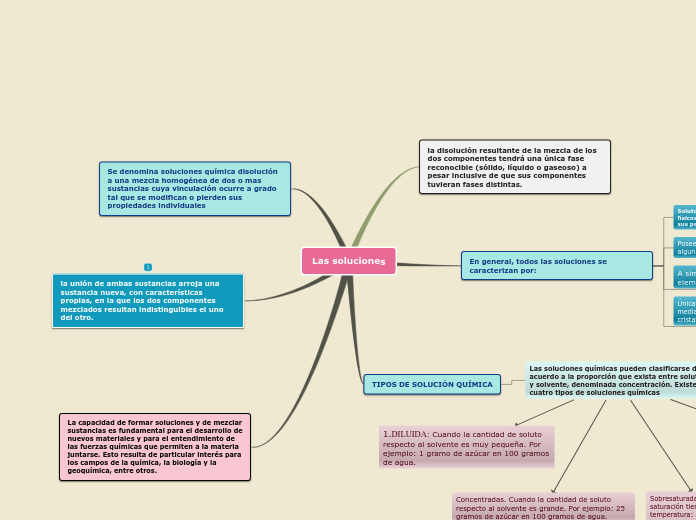
Una solución química es una mezcla homogénea de dos o más sustancias cuyos componentes se unen de tal manera que pierden sus propiedades individuales y forman una nueva sustancia con características propias.