Quimica conceptos
Componentes atómicos
Neutrones
Concentradas en un núcleo muy pequeño y por partículas con carga negativa denominada como neutrones.
Electrones
El núcleo de los átomos contiene otro tipo de partículas sin carga eléctrica conocidas como neutrones
Protones
Cada átomo esta constituido por partículas con carga positiva, llamadas protones
Estructura atómica
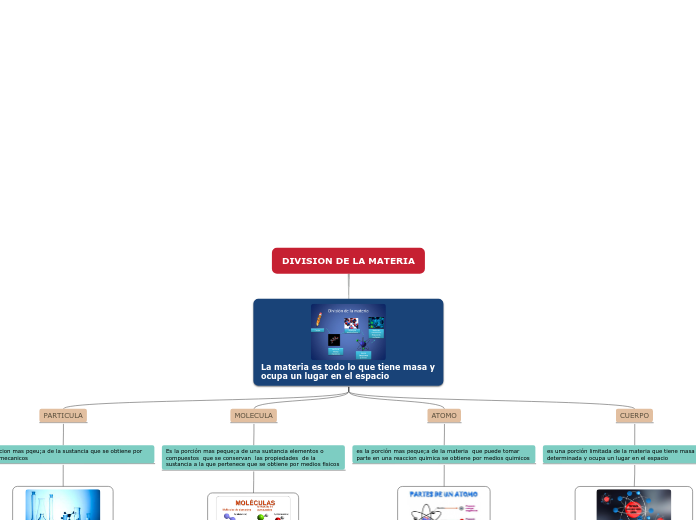
Molécula
Es la combinación de átomos que fija todas las propiedades de la materias
Ejemplos
Color, Olor, sus propiedades físicas químicas
Átomos
Son las partículas que determinan la naturaleza de la materia.
Hidrógeno, Litio, Azufre, ect.
Cantidad de las sustancias
Constante de Avogadro
Es el número de partículas constituyentes que se encuentran en la cantidad de sustancia de un mol
Mol
Equivale a:
6.023x10^23
Número de partícula
El número de partículas que contiene un mol, siempre es el mismo sin importar la sustancia considerada
Ley de conversación
Una ley general denominada "de la conservación de la masa" la cual establece que "nada se crea, nada se destruye, solo se transforma", se considera que la masa de las sustancias era una medida directa de la cantidad de materia presentes de ellas, Por eso los resultados se conocen como Ley de conservación de la materia o de la masa
Ejempló:
La masa de este recipiente sellado es la misma antes y después de que el cerillo se quemara
Identidad atómica
Masa atómicas
Los distintos átomos y se simbolizan por letra A, Medir la masa de un solo átomo es muy dificil,pero es posible determinar cuantas veces la masa de un átomo es más grande relación con otro
A=3
Numero atómico
La identidad de cada atomo lo determina su número de protones,Este estado se conoce como número atómico y se representa con la letra z
Z=1
Reacciones química
Balanceo de ecuaciones químicas
implica que todos los elementos presentes en dicha ecuación tienen el mismo número de átomos a cada lado. Para lograr esto se hace necesario utilizar los métodos de balanceo para asignar los coeficientes estequiométricos adecuados a cada especie presente en la reacción.
El pentóxido de fósforo y el agua se convierten en ácido fosfórico.
Ecuaciones químicas
Una ecuación química es una descripción simbólica de una reacción química. Muestra las sustancias que reaccionan (llamadas reactivos) y las sustancias que se originan (llamadas productos).
Fotosíntesis. Ecuación de la fotosíntesis
Sustancias Elementales y compuestos químicos
compuestos químicos
Sustancias que se descomponen con otras más elementales a partir de métodos quimicos,esto es, procedimiento que alteran la naturaleza química de las sustancias.
Azúcar, Cloruro de sodio, Dióxido de carbono, y Yoduro de potasio
Sustancias Elementales
El resultado de la descomposición de compuestos químicos son sustancias que ya no son posible transformar en otras mas simples y se les domina sustancias elementales
Hidrogeno,oxigeno,Nitrogeno,Yodo,Oro,Plata,Mante
Tipos de mezclas
Homogeneas
Métodos más comunes que son la filtración y la decantación
Destilacion:Se utilizan los diferentes estilos de ebullicion de las sustancias de las mezclas
Extracción:Se basa en diferencias de solublidad de las sustancias
Cromatografia:Metodo mas versatil se basa en las diferencias en que distintas sustnacias se atraen entre si,Tienen dos fases:Estacionaria y Movil
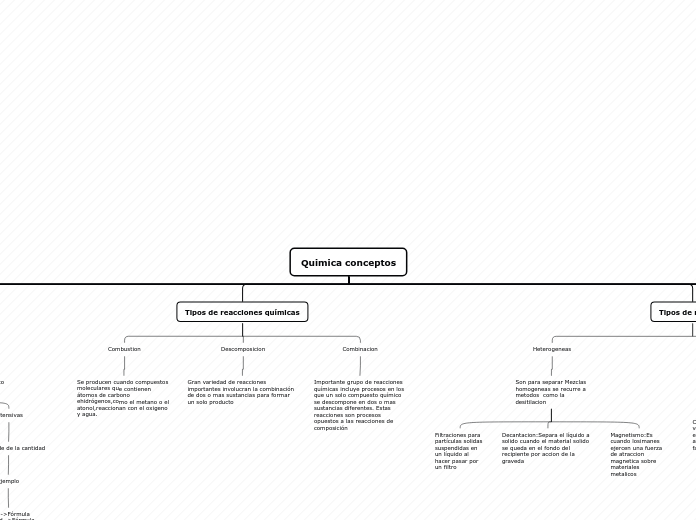
Heterogeneas
Son para separar Mezclas homogeneas se recurre a metodos como la desitilacion
Magnetismo:Es cuando losimanes ejercen una fuerza de atraccion magnetica sobre materiales metalicos
Decantacion:Separa el líquido a solido cuando el material solido se queda en el fondo del recipiente por accion de la graveda
Filtraciones para partículas solidas suspendidas en un líquido al hacer pasar por un filtro
Tipos de reacciones químicas
Combinacion
Importante grupo de reacciones químicas incluye procesos en los que un solo compuesto químico se descompone en dos o mas sustancias diferentes. Estas reacciones son procesos opuestos a las reacciones de composición
Descomposicion
Gran variedad de reacciones importantes involucran la combinación de dos o mas sustancias para formar un solo producto
Combustion
Se producen cuando compuestos moleculares que contienen átomos de carbono ehidrógenos,como el metano o el atonol,reaccionan con el oxigeno y agua.
Propiedades
Cuantitativas
se les asigna un valor numerico
Intensivas
No depende de la cantidad
Densidad-->Fórmula
Solubilidad-->Fórmula
Conductividad-->Electrica
Vicosidad,Temp.fusion
Extensivas
Depende de la cantidad
Masa,Pesas o basculas,Volumen,int. de medicina
Cualitativos
No depende de un valor numerico
Subtopic
Color sabor
Dureza Olor
Brillo Transparencia Flexibilidad
Estequiometria
Estudia cómo determian las cantidades de reactivos que es necesario hacer reaccionar para formar la cantidad de producto que se necesita(Ecuación química balanceada que determina las proporciones entre reactivos y productos en una reacción química)
Producto
Este método permite predecir las cantidades de productos
Ácidos y Bases
Base
Sustancia del sabor amargo y aspecto jabonoso
Características
En disolución acuosa tiene sabor amargo, hace que el papel torne de rojo a azul, se siente resbaloso al tacto.
Acido
Sustancia que tiene sabor agrio reacciona con los metales liberando hidrógeno
Características:
Hace que el papel torne cambie de azul a rojo, Reacciona con metales activos como el magnesio, Reacciona con los compuestos llamados bases
Indicadores
Son compuestos orgánicos que poseen colores variables, Según el PH de la solución, los mas utilizados son los ácidos débiles
Reacciones Ácido-Base
Los acidos y las bases reacionan entre si;Como resultado de esas reacciones ácido base se producen sustancias químicas con propiedades distintas.La reacción química entre un ácido y una base fundamental da como producto agua y una sal
Composición y estructura de las sustancias
Tipos de sustancias
Sustancias metálicas
Se caracteriza por su buena conductividad de electricidad y de calor
Compuestos iónicos
Es aquel que se forma cuando un átomo baja afinidad de electronica cede electrones conduce electricidad convertiendose en un anión(conducen electricidad)
Oxido de magnesio, Carbonato de calcio
Sustancias moleculares
Son resultado de la combinación de elementos químicos no metálicos(No conducen electricidad)
Ejemplo
Acetona,Monoxido de carbono, Dioxido de carbono.
Geometría molecular
Plana
la geometría molecular trigonal plana es un tipo de geometría molecular con un átomo en el centro y tres átomos en las esquinas de un triángulo, llamados átomos periféricos, todo ellos en el mismo plano
Lineal
la geometría molecular lineal describe la disposición de distintos átomos con enlaces de 180º.Las moléculas orgánicas lineales, como el acetileno, suelen presentar hibridación de tipo sp en los átomos de carbono.
Reacciones de Oxidación-Reducción
Formación de enlaces
Los enlaces químicos se forman ganando, cediendo o compartiendo electrones para alcanzar configuraciones electrónicas estables como por ejemplo las de los gases nobles.
Reacciones endotérmicas
Una reacción endotérmica es un tipo de reacción química en la que se consume energía en forma de calor, por lo que el producto obtenido tiene una energía mayor que los reactivos iniciales
Reacciones exotérmicas
La mayoría de las reacciones exotérmicas son de oxidación, y de ser muy violentas pueden generar fuego, tal y como la combustión. Lo mismo ocurre en las transiciones de la materia de un estado de agregación a otro de menor energía, como de gas a líquido
Oxidación-Reducción
Se denomina reacción de reducción-oxidación, de óxido-reducción o, simplemente como reacción rédox, a toda reacción química en la que uno o más electrones se transfieren entre los reactivos, provocando un cambio en sus estados de oxidación.
Velocidad de reacción
La velocidad de reacción se define como la cantidad de sustancia que se transforma en una determinada reacción por unidad de volumen y tiempo. Por ejemplo, la oxidación del hierro bajo condiciones atmosféricas es una reacción lenta que puede tardar muchos años, pero la combustión del butano en un fuego es una reacción que sucede en fracciones de segundos.
La importancia de la rapidez de las partículas en las reacciones
En una reacción química, si hay mucha cantidad de partículas, el número de colisiones entre ellas será muy alta, por lo que la velocidad de la reacción será alta. A mayor concentración de las sustancias reaccionantes, mayor va a ser la velocidad de reacción de formación de los productos