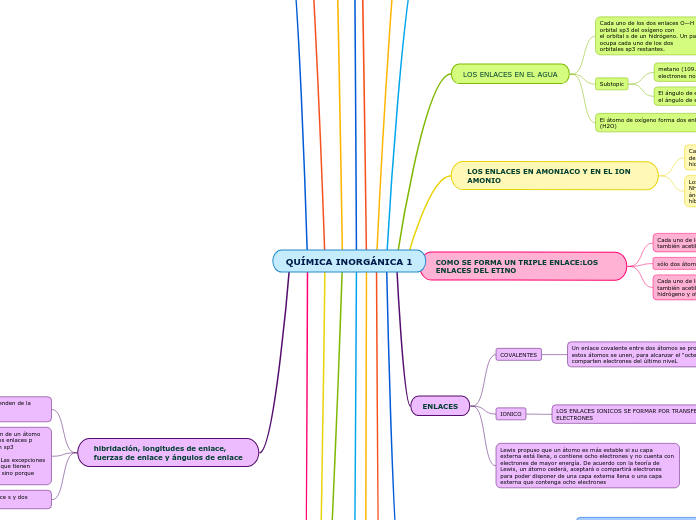
QUÍMICA INORGÁNICA 1
La segunda definición de ácidos y bases:
ácidos y bases de Lewis
Definió a un ácido como una especie que acepta un par de electrones y a una base como una especie que cede un par de electrones. Todos los ácidos que ceden protones se ajustan a la definición de Lewis, porque todos ellos pierden un protón, y el protón acepta un par
de electrones.
COMO SE FORMA EL DOBLE ENLACE:LOS ENLACES DEL ETANO
cada carbono combina tres orbitales atómicos: un orbital s y dos de los orbitales p
Cada uno de los átomos de carbono en el eteno (al que también se le llama etileno) forma
COMO SE FORMAN LOS ENLACES SENCILLOS EN LOS COMPUESTOS ORGANICOS
Los enlaces del metano
El metano (CH4) tiene cuatro enlaces covalentes C—H. Como los cuatro enlaces tienen la
misma longitud, 1.10 Å, y todos los ángulos de enlace son iguales, 109.5°, se puede concluir que los cuatro enlaces C—H del metano son idénticos
SuLos enlaces del etano
Los dos átomos de carbono del etano (CH3CH3) son tetraédricos. Cada carbono usa cuatro
orbitales sp3 para formar cuatro enlaces covalentes
hibridación, longitudes de enlace,
fuerzas de enlace y ángulos de enlace
los enlaces triples están formados por un enlace s y dos enlaces p
La forma más fácil de determinar la hibridación de un átomo de carbono, oxígeno o nitrógeno es ver cuántos enlaces p forma: si no forma enlaces p, tiene hibridación sp3
; si forma un enlace p, tiene hibridación sp2
; si forma dos enlaces p, tiene hibridación sp. Las excepciones son los carbocationes y los radicales carbono, que tienen hibridación sp2 no porque formen un enlace p sino porque tienen un orbital p vacío o a medio llena
La longitud y la fuerza de un enlace C—H dependen de la hibridación del átomo de
carbono al cual se fija el hidrógeno
Fuerza de un ácido en función
de los sustituyentes
Aunque el protón ácido de cada uno de los siguientes cuatro ácidos carboxílicos está fijo al mismo átomo (de oxígeno), la acidez de los cuatro compuestos son diferente.
ORBITALES ATOMICOS
sin embargo, el principio de incertidumbre de Heisenberg establece que el lugar y la cantidad de movimiento exactos de una partícula atómica no se pueden determinar al mismo
Un electrón en un orbital 1s puede estar en cualquier lugar dentro de la esfera 1s, pero un
orbital 2s tiene una región donde la probabilidad de encontrar un electrón baja a cero. A esto se le llama nodo radial.ic
Cómo se representa la estructura de un compuesto
CARGA FORMAL
carga formal � número de electrones de valencia
ESTRUCTURAS DE KEKULE
En el benceno cada átomo de carbono ocupa el vértice de un hexágono regular, aparentemente tres de las cuatro valencias de los átomos de carbono se utilizan para unir átomos de carbono contiguos entre sí, y la cuarta valencia con un átomo de hidrógeno
ESTRUCTURAS DE LEWIS
Esta representación se usa para saber la cantidad de electrones de valencia de un elemento que interactúan con otros o entre su misma especie, formando enlaces ya sea simples, dobles, o triples y estos se encuentran íntimamente en relación con los enlaces químicos entre las moléculas y su geometría molecular, y la distancia que hay entre cada enlace formado.
LA ETRUCTURA DE UN ATOMO
El número de masa de un átomo es la suma de sus protones y neutrones.
El número atómico de un átomo es igual al número de protones en su núcleo
Un átomo consiste en un diminuto núcleo, denso, rodeado por electrones dispersos
asigna electrones a un volumen de espacio llamado orbital. Según la teoría de los orbitales moleculares, los enlaces covalentes se forman cuando se combinan los orbitales atómicos para
la teoría de los orbitales moleculares (TOM), es un método para determinar el enlace químico en el que los electrones no están asignados a enlaces individuales entre átomos, sino que se mueven bajo la influencia de los núcleos de toda la molécula
asigna electrones a un volumen de espacio llamado orbital. Según la teoría de los orbitales moleculares, los enlaces covalentes se forman cuando se combinan los orbitales atómicos para formar enlaces
Ácidos y bases orgánicos
Ácidos
ácidos carboxílicos tienen valores de pKa que se encuentran alrededor de 3 a 5. Son ácidos moderadamente fuertes.
Los ácidos orgánicos más comunes son los ácidos carboxílicos, compuestos que tienen un
bases
Los alcoholes son compuestos que tienen un grupo OH y son ácidos mucho más débiles
que los ácidos carboxílicos; sus valores de pKa se acercan a 16.
Cómo pronosticar el resultado
de una reacción ácido-base
El equilibrio favorece la reacción del ácido más fuerte y la formación del ácido más débil. En otras palabras, el fuerte reacciona para formar el débil.
Para determinar la posición del equilibrio para una reacción ácido-base (es decir, si en el equilibrio se favorece a los reactivos o a los productos), es necesario comparar el valor
de pKa del ácido a la izquierda de la flecha con el valor de pKa del ácido a la derecha de la flecha
es una reacción química que ocurre entre un ácido y una base produciendo sal y agua.
ENLACES
Lewis propuso que un átomo es más estable si su capa externa está llena, o contiene ocho electrones y no cuenta con
electrones de mayor energía. De acuerdo con la teoría de Lewis, un átomo cederá, aceptará o compartirá electrones para poder disponer de una capa externa llena o una capa externa que contenga ocho electrones
IONICO
LOS ENLACES IONICOS SE FORMAR POR TRANSFERENCIA DE ELECTRONES
Para que un enlace iónico se genere es necesario que la diferencia de electronegatividades sea mayor que 1,7 o igual
Eso se da cuando en el enlace, uno de los átomos capta electrones del otro
COVALENTES
Un enlace covalente entre dos átomos se produce cuando estos átomos se unen, para alcanzar el "octeto estable", y comparten electrones del último niveL
Los enlaces covalentes se producen entre átomos de un mismo elemento no metal, entre distintos no metales y entre un no metal y el hidrógeno
Un enlace covalente entre dos átomos se produce cuando estos átomos se unen, para alcanzar el "octeto estable", y comparten electrones del último nive
COMO SE FORMA UN TRIPLE ENLACE:LOS ENLACES DEL ETINO
Cada uno de los átomos de carbono del etino (llamado también acetileno) está enlazado a sólo dos átomos: uno de hidrógeno y otro de carbono
sólo dos átomos: uno de hidrógeno y otro de carbono:
Cada uno de los átomos de carbono del etino (llamado también acetileno) está enlazado a
LOS ENLACES EN AMONIACO Y EN EL ION AMONIO
Los ángulos de enlace observados en forma experimental en el NH3 son de 107.3°. Esos
ángulos indican que también el nitrógeno usa orbitales híbridos cuando forma enlaces covalentes
Cada uno de los enlaces N—H del NH3 se forma por traslape de un orbital sp3 del nitrógeno con el orbital s de un hidrógeno.
LOS ENLACES EN EL AGUA
El átomo de oxígeno forma dos enlaces covalentes en el agua (H2O)
Subtopic
El ángulo de enlace en el agua (104.5°) es un poco menor que el ángulo de enlace en el
metano (109.5°), debido a que cada uno de los pares de electrones no enlazados sólo está sujeto por un núcleo, l
Cada uno de los dos enlaces O—H se forma por traslape de un orbital sp3 del oxígeno con
el orbital s de un hidrógeno. Un par de electrones no enlazado ocupa cada uno de los dos
orbitales sp3 restantes.
Enlaces en el catión metilo, radical metilo
y anión metilo
El catión metilo (+CH3)
El carbono con carga positiva del catión metilo está unido a tres átomos, por lo que hibrida
tres orbitales —un orbital s y dos orbitales p.
El anión metilo (–
CH3)
El carbono del anión metilo tiene carga negativa y dispone de tres pares de electrones enlazan tes y un par de electrones no enlazado.
INTRODUCCION A LOS ACIDOS Y BASES
En las definiciones de Brønsted-Lowry, un ácido es una
especie que dona o cede un protón y una base es una especie que acepta un protón. (Recuérdese que los iones hidrógeno con carga positiva se llaman protones).
A la reacción de un ácido con una base se le llama reacción ácido-base o reacción de transferencia de protón
La basicidad es una medida de la afinidad de un compuesto hacia un protón.
MOMENTOS DIPOLARES DE LAS MOLECULAS
El momento dipolar se da en las sustancias moleculares; es decir,
aquellas sustancias que presentan interacciones covalentes, y
representa la distribución de la densidad electrónica en un enlace.
LOS ENLACES EN LOS HALOGENUROS E HIDROGENO
Haluro de hidrógeno (también llamado halogenuro de hidrógeno o en su forma disuelta ácido halhídrico o ácido halogenhídrico) es un tipo de compuesto químico resultante de la reacción química del hidrógeno con uno de los elementos halógenos (flúor, cloro, bromo, y yodo), que se encuentran en el grupo 17 (VII, VIIA) de la tabla periódica