por Ярослав Язов 1 ano atrás
208
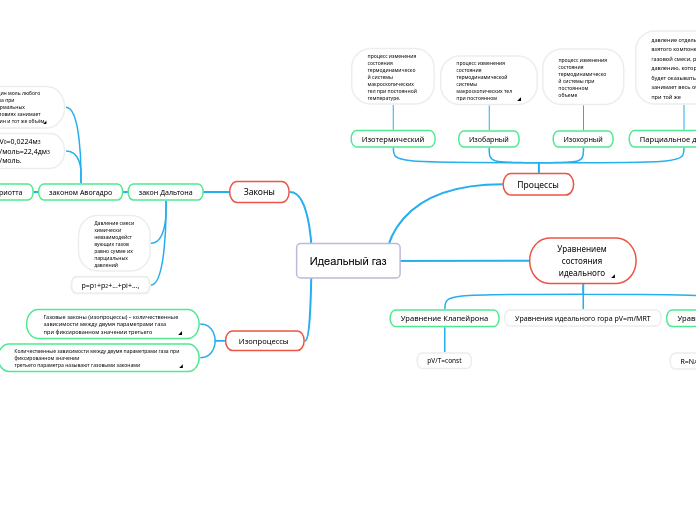
Идеальный газ
Изучение поведения идеального газа охватывает различные термодинамические процессы, такие как изотермический, изохорный и изобарный, которые описывают изменения состояния системы при постоянной температуре, объеме и давлении соответственно.