por Палицына Анфиса 10 meses atrás
102
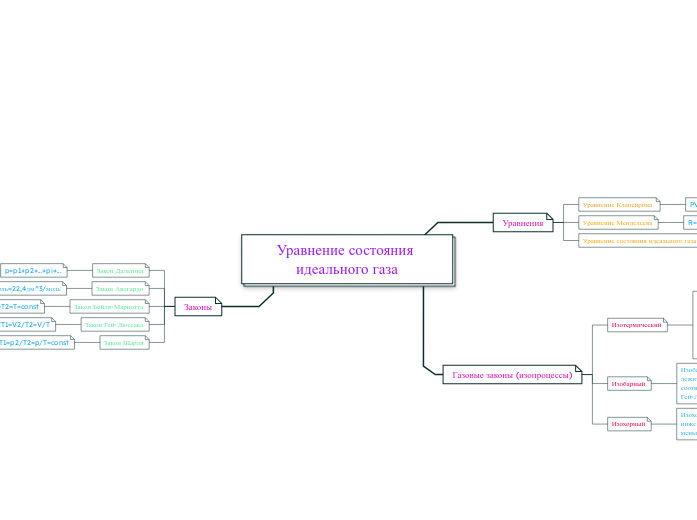
Уравнение состояния идеального газа
В тексте рассматриваются различные законы и уравнения, описывающие поведение идеального газа. Приводятся основные законы, такие как закон Дальтона, утверждающий, что общее давление смеси газов равно сумме парциальных давлений отдельных газов, и закон Авогадро, который устанавливает объем одного моля идеального газа при стандартных условиях.