I. Горят коптящим пламенем
CnH2n-6 + 1,5 O2 --t--> nCO2 + n-3H2O
II. Реакции замещения
- протекают по радикальному механизму
- без разрыва п - связей
- при наличии заместителя в кольце могут протекать в разных положениях
- Галогенирование !!!Бензол реагирует только с чистыми галогенами!!!
C6H6 + Cl2 --AlCl3; t--> C6H5-Cl +HCl
!!! 2C6H5-CH3 + 2Cl2 --AlCl3;t-->C6H5-CH3-Cl + C6H5-CH3-Cl + 2HCl
(Cl2-раствор; (Cl-орто) (Cl-пара)
недостаток)
!!! 2C6H5-CH3 + 3Cl2 --AlCl3;t--> C6H3-CH3-Cl-Cl-Cl + 3HCl
(Cl2-избыток) (Cl-в орто и пара положение)
!!! 2C6H5-CH2Cl + Cl2 -> C6H3-CH2Cl-Cl+ HCl
(Cl-в мето положении)
- Нитрирование
C6H6 + HNO3 --H2SO4-->C6H5-NO2 + H2O
(раствор)
C6H6- CH3 + 3HNO3 --H2SO4--> C6H3-CH3-NO2-NO2-NO2 + 3H2O
(концентрированное)
IV. Окисление
!!! Бензол не окисляется KMnO4 и не обесцвечивает его!!!
!!! Окисляться может только баковая цепь!!!
5C6H5-C2H5 + 12KMnO4 + 18H2SO4 --t--> 5C6H5-C=O +5CO2
|
OH
+6K2So4 + 12MnSO4 +23H2O
V. Реакция в заместители
- Реакция присоединения
C6H5-CH=CH2 + H2 --Ni;t--> C6H5-CH2-CH3
!!! Точно так же протекают реакции галогенирование, гидратации, гидрогалогенирования, полимеризации!!!
- Реакция замещения
Если радикал в кольце содержит несколько атомов C, замещение протекает у менее гидрированного
C6H5-CH2-CH3 + Br2 --свет--> C6H5-CHBr + HBr
V. Реакция в заместители
1.Реакция присоединения
C6H5-CH=CH2 + H2 --Ni;t--> C6H5-CH2-CH3
!!! Точно так же протекают реакции галогенирование, гидратации, гидрогалогенирования, полимеризации!!!
2.Реакция замещения
Если радикал в кольце содержит несколько атомов C, замещение протекает у менее гидрированного
C6H5-CH2-CH3 + Br2 --свет--> C6H5-CHBr + HBr
Характеристика заместителей в бензольном кольце:
1. Заместители I рода
а) обогащают бензольное кольцо своеё электронной плотностью, которая распределяется в кольце 2,4,6 (орто и пара)
б) последующие заместители будут замещаться в кольце именно в положениях 2,4,6
в) к ним относят:
-все углеводородные радикалы
-галогены
-аминогруппа
-гидроксогруппа
2. Заместители II рода
а)вытягивают из кольца электронную плотность
б)затрудняют реакции замещения в положении 2,4,6
в)направляют все последующие заместители в мето положени (3,5)
г) к ним относятся:
-все функциональные группы, -содержащие кислород !КРОМЕ OH!
-галогенозамещенные радикалы
III. Реакции присоединение
-по радикальному механизму
-с разрывом сопряженных п - связей
1.Хлорирование
C6H6 + 3Cl2 --свет-->C6H6Cl12
2.Гидрирование
C6H6+ 3H2 --Pt;t-->C6H12
IV. Окисление
!!! Бензол не окисляется KMnO4 и не обесцвечивает его!!!
!!! Окисляться может только баковая цепь!!!
5C6H5-C2H5 + 12KMnO4 + 18H2SO4 --t--> 5C6H5-C=O +5CO2
|
OH
+6K2So4 + 12MnSO4 +23H2O
Арены (ароматические углеводороды) - углеводороды, молекулы которых содержат бензольное кольцо - замкнутую, сопряженную электронную п- систему.
II. Реакции замещения
-протекают по радикальному механизму
-без разрыва п - связей
-при наличии заместителя в кольце могут протекать в разных положениях
1. Галогенирование !!!Бензол реагирует только с чистыми галогенами!!!
C6H6 + Cl2 --AlCl3; t--> C6H5-Cl +HCl
!!! 2C6H5-CH3 + 2Cl2 --AlCl3;t-->C6H5-CH3-Cl + C6H5-CH3-Cl + 2HCl
(Cl2-раствор; (Cl-орто) (Cl-пара)
недостаток)
!!! 2C6H5-CH3 + 3Cl2 --AlCl3;t--> C6H3-CH3-Cl-Cl-Cl + 3HCl
(Cl2-избыток) (Cl-в орто и пара положение)
!!! 2C6H5-CH2Cl + Cl2 -> C6H3-CH2Cl-Cl+ HCl
(Cl-в мето положении)
2. Нитрирование
C6H6 + HNO3 --H2SO4-->C6H5-NO2 + H2O
(раствор)
C6H6- CH3 + 3HNO3 --H2SO4--> C6H3-CH3-NO2-NO2-NO2 + 3H2O
(концентрированное)
III. Реакции присоединение
- по радикальному механизму
- с разрывом сопряженных п - связей
- Хлорирование
C6H6 + 3Cl2 --свет-->C6H6Cl12
- Гидрирование
C6H6+ 3H2 --Pt;t-->C6H12
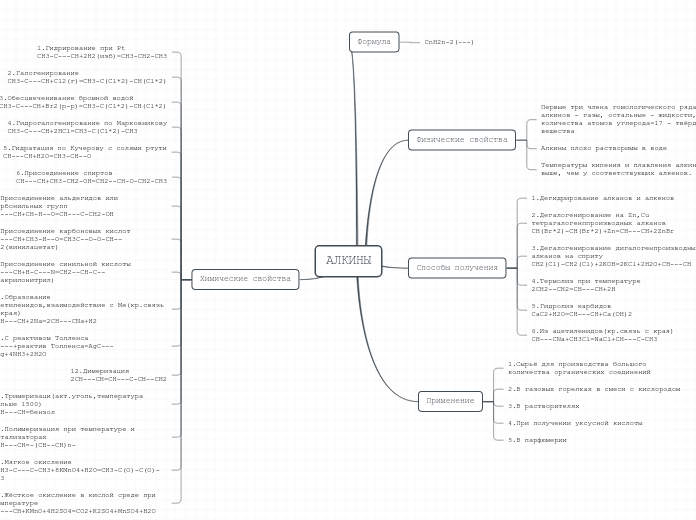
Химические свойства
Химические свойства:
I. Горят коптящим пламенем
CnH2n-6 + 1,5 O2 --t--> nCO2 + n-3H2O
II. Реакции замещения
- протекают по радикальному механизму
- без разрыва п - связей
- при наличии заместителя в кольце могут протекать в разных положениях
- Галогенирование !!!Бензол реагирует только с чистыми галогенами!!!
C6H6 + Cl2 --AlCl3; t--> C6H5-Cl +HCl
!!! 2C6H5-CH3 + 2Cl2 --AlCl3;t-->C6H5-CH3-Cl + C6H5-CH3-Cl + 2HCl
(Cl2-раствор; (Cl-орто) (Cl-пара)
недостаток)
!!! 2C6H5-CH3 + 3Cl2 --AlCl3;t--> C6H3-CH3-Cl-Cl-Cl + 3HCl
(Cl2-избыток) (Cl-в орто и пара положение)
!!! 2C6H5-CH2Cl + Cl2 -> C6H3-CH2Cl-Cl+ HCl
(Cl-в мето положении)
- Нитрирование
C6H6 + HNO3 --H2SO4-->C6H5-NO2 + H2O
(раствор)
C6H6- CH3 + 3HNO3 --H2SO4--> C6H3-CH3-NO2-NO2-NO2 + 3H2O
(концентрированное)
III. Реакции присоединение
- по радикальному механизму
- с разрывом сопряженных п - связей
- Хлорирование
C6H6 + 3Cl2 --свет-->C6H6Cl12
- Гидрирование
C6H6+ 3H2 --Pt;t-->C6H12
IV. Окисление
!!! Бензол не окисляется KMnO4 и не обесцвечивает его!!!
!!! Окисляться может только баковая цепь!!!
5C6H5-C2H5 + 12KMnO4 + 18H2SO4 --t--> 5C6H5-C=O +5CO2
|
OH
+6K2So4 + 12MnSO4 +23H2O
V. Реакция в заместители
- Реакция присоединения
C6H5-CH=CH2 + H2 --Ni;t--> C6H5-CH2-CH3
!!! Точно так же протекают реакции галогенирование, гидратации, гидрогалогенирования, полимеризации!!!
- Реакция замещения
Если радикал в кольце содержит несколько атомов C, замещение протекает у менее гидрированного
C6H5-CH2-CH3 + Br2 --свет--> C6H5-CHBr + HBr
Общая формула: CnH2n-6 (n>6)
Каждый из 6 атомов C после гибридизации
Физические свойства:
Бензол - бесцветная жидкость с приятным запахом, температура кипения 80,1 градус по Цельсию, температура плавления 5,5 градус по Цельсию.
! ЯДОВИТ!
Каждый из 6 атомов C находится во || валентности
НО: в бензоле количество π-связей = 0
Наличие замкнутой сопряженной п - системы у аренов объясняет особенности их химические свойства: замещение и присоединение.
Получение:
I. Реакция алкилирование - введение в бензольное кольцо алкильного радикала (предельного).
1. Галогеналканами
C6H6 + CH3-Br --AlCl3; t-->C6H5-CHBr + HCl
2.Реакция Вюрца - Фиттинга
C6H5-Cl + CH3-Cl + 2Na --t-->2NaCl + C6H5-CH3
3.Алканами
C6H6 + CH3-CH2=CH2 --H3PO4; t--> C6H5-(CH3)2
II. Ароматизация
С-С-С-С-С-С --Pt; t--> C6H6 + 4H2
(n- гексан C6H12)
III. Дегидрирование циклоалканами
C6H12 --Pt; t--> C6H6 + 3H2
IV. Из каменно-угольной смолы
V. Реакция Зелинского
3C2H2 --Cакт; 450-600t-->C6H6
Химические свойства:
I. Горят коптящим пламенем
CnH2n-6 + 1,5 O2 --t--> nCO2 + n-3H2O
Каждый из 6 атомов C находиться во II валентном состоянии значит из 4 орбиталей внешнего уровня 3 орбитали гибридизации 1 не гибридная образует п-связь с соседним атомом C
Каждый из 6 атомов C после гибридизации имеет по одной не гибридной p - орбитали. Таких орбиталей 6. Они расположены перпендикулярно плоскости цикла и перекрывают друг друга над и под циклом, образуя две тороидальные орбитали, которые являются составляющими замкнутой сопряженной единой п - системой.
Наличие замкнутой сопряженной п - системы и аренов объясняет особенности их химических свойств: р. защемление и р. присоединение.