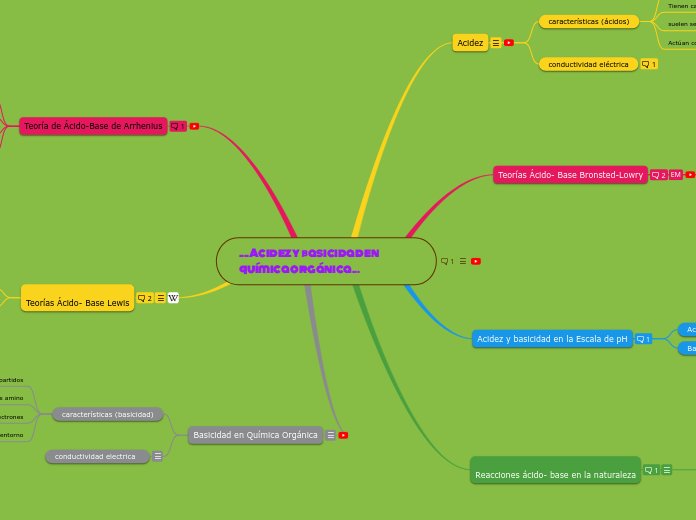
....Acidez y basicidad en química orgánica...
En el contexto de la química orgánica, la acidez y la basicidad son dos propiedades importantes que se refieren a la capacidad de una sustancia para donar o aceptar protones (iones positivos de hidrógeno) en una reacción química.
La acidez se refiere a la capacidad de una sustancia para donar protones. Las sustancias ácidas tienden a liberar protones en solución acuosa, lo que resulta en un aumento de la concentración de iones de hidrógeno. Por ejemplo, el ácido clorhídrico (HCl) es una sustancia ácida que se disocia en agua para formar iones H+ y Cl-.
Por otro lado, la basicidad se refiere a la capacidad de una sustancia para aceptar protones. Las sustancias básicas, también conocidas como alcalinas, tienden a aceptar protones en solución acuosa, lo que resulta en una disminución de la concentración de iones de hidrógeno. Un ejemplo de sustancia básica es el hidróxido de sodio (NaOH), que se disocia en agua para formar iones Na+ y OH-.
La acidez y la basicidad son propiedades fundamentales en la química orgánica, ya que influyen en la reactividad y en la forma en que las sustancias orgánicas interactúan entre sí. Además, estas propiedades también son importantes en otras áreas de la química, como la bioquímica y la farmacología, donde se estudia el comportamiento de los compuestos orgánicos en sistemas biológicos.
La acidez y la basicidad son propiedades de las sustancias que dependen de la concentración de iones hidrógeno (H^+)
Basicidad en Química Orgánica
- Los compuestos orgánicos que contienen grupos con pares de electrones no compartidos (por ejemplo, grupos amino) son bases en química orgánica. Estos grupos son capaces de aceptar protones.
- Ejemplo: La amina primaria, como la anilina (C₆H₅NH₂), es una base orgánica. El átomo de nitrógeno en el grupo amino tiene un par de electrones no compartidos y puede aceptar un protón para formar el ion amonio (C₆H₅NH₃⁺) en reacciones ácido-base.
conductividad electrica
- La conductividad eléctrica de una solución acuosa está relacionada con la movilidad de los iones en esa solución. Cuantos más iones haya en la solución, mayor será su capacidad para conducir la electricidad.
- En el ejemplo anterior con el hidróxido de sodio (NaOH), la disociación de la base en iones aumenta la conductividad eléctrica de la solución. Los iones cargados, como el ion sodio (Na⁺) y el ion hidroxilo (OH⁻), pueden transportar cargas eléctricas y permitir que la solución conduzca electricidad.
características (basicidad)
Influencia del entorno
Estructura electrónica rica en electrones
Grupos amino
Pares de electrones no compartidos
Teorías Ácido- Base Lewis
La medida de la concentración de iones hidrógeno (H+) en una solución
La teoría ácido-base de Lewis, propuesta por Gilbert N. Lewis, es una teoría más amplia y versátil en comparación con la teoría de Brønsted-Lowry, ya que no se limita a la transferencia de protones (H⁺). Según la teoría de Lewis, un ácido es una sustancia que puede aceptar un par de electrones, y una base es una sustancia que puede donar un par de electrones. Aquí se explica cómo se aplican los conceptos de acidez y basicidad en la teoría ácido-base de Lewis:
La teoría ácido-base de Lewis es fundamental en la química de coordinación y se utiliza ampliamente para comprender y predecir reacciones químicas en las que se forman enlaces de coordinación. Ofrece una perspectiva más amplia de la acidez y la basicidad al centrarse en la compartición de pares de electrones, lo que la hace especialmente útil para comprender las interacciones en sistemas químicos complejos.
Base de Lewis
- Una base de Lewis es una sustancia que puede donar un par de electrones a un ácido de Lewis. Es capaz de compartir su par de electrones no enlazados con un ácido.
- Ejemplos de bases de Lewis incluyen el ion hidruro (H⁻) y el ion amoníaco (NH₃). Estas sustancias tienen pares de electrones no compartidos que pueden donar para formar enlaces químicos con ácidos de Lewis.
Ácido de Lewis
- Un ácido de Lewis es una sustancia que tiene un sitio vacante en su estructura electrónica para aceptar un par de electrones. En otras palabras, es una especie química que busca compartir un par de electrones con una base.
- Ejemplos de ácidos de Lewis incluyen el ion metálico Al³⁺ y el cloruro de boro (BCl₃). Estas sustancias tienen vacantes electrónicas en sus estructuras que pueden aceptar pares de electrones de una base.
Teoría de Ácido-Base de Arrhenius
La teoría de ácido-base de Arrhenius es una de las primeras teorías propuestas para describir el comportamiento ácido-base en la química. Fue propuesta por Svante Arrhenius en 1884 y se centra en la disociación de sustancias en soluciones acuosas. En el contexto de la química orgánica, esta teoría puede aplicarse de la siguiente manera:
Neutralización
La reacción entre un ácido y una base en solución acuosa da como resultado la formación de agua (H₂O) y una sal. En química orgánica, las reacciones de neutralización pueden ocurrir entre ácidos y bases orgánicas, produciendo compuestos orgánicos y, a menudo, agua como producto.
Reacciones Ácido-Base según Arrhenius
En reacciones ácido-base, los ácidos donan protones (H⁺), y las bases aceptan protones (H⁺). En la química orgánica, esto se traduce en reacciones en las que los compuestos orgánicos actúan como ácidos donando protones o como bases aceptando protones. Por ejemplo, en una reacción entre un ácido carboxílico y una amina, el ácido carboxílico donará un protón (H⁺) a la amina.
Base según Arrhenius
Una base, según Arrhenius, es una sustancia que libera iones hidroxilo (OH⁻) en una solución acuosa. En química orgánica, las bases pueden ser compuestos que contienen el grupo hidroxilo (-OH), como alcoholes y aminas.
Ácido según Arrhenius
Un ácido, según Arrhenius, es una sustancia que libera iones hidrógeno (H⁺) en una solución acuosa. En química orgánica, los ácidos pueden ser compuestos orgánicos que liberan protones (H⁺) en soluciones acuosas, como los ácidos carboxílicos.
Reacciones ácido- base en la naturaleza
Alcalinidad y pH.
Al analizar los sistemas acuáticos naturales es de vital importancia analizar y
determinar la concentración total de hidrógenos en dicho sistema, para que de esta
manera podamos conocer la alcalinidad del sistema.
En la naturaleza se dan comúnmente los equilibrios químicos. Cuando hablamos de
equilibrio ácido base nos referimos a las reacciones químicas que se dan por el
intercambio de protones en un medio acuoso. Así pues las reacciones ácido base en la
naturaleza involucran los equilibrios químicos que se dan en diferentes sistemas
acuáticos. (ejemplo arrecifes, ríos, lagos, aguas oceánicas" entre otros).
En la vida diaria son muchas las situaciones donde se dan reacciones ácido base, y dónde es importante controlar la acidez o alcalinidad. Algunas de estas situaciones son:
Productos de limpieza
En los productos de limpieza de la cocina encontramos ácidos y bases fuertes. Como ácido más utilizado en la limpieza tendríamos el salfumán (ácido clorhídrico), utilizado para por ejemplo óxidos en metal, o en decapados de pinturas, y como bases fuertes el hidróxido de sodio (NaOH), utilizado para disolver grasas o como desatascador, la lejía (Hipoclorito de sodio – NaClO) o el Amoníaco (NH3). Seguramente has oído que no se pueden mezclar estos productos de limpieza, ya que las reacciones entre ellos pueden ser peligrosas.
Conservación de alimentos
Algunos ácidos se pueden emplear como conservantes de alimentos, ya que la acción bacteriana no se produce a pH bajo. Ácido cítrico, acético, sórbico, son ejemplos de estas sustancias. Por ejemplo las sardinas en escabeche, o boquerones en vinagre, utilizando el ácido acético (vinagre). El ceviche se prepara con pescado blanco y ácido cítrico (jugo del limón)
Estómago y jugos gástricos. Antiácidos para ardor de estómago.
El jugo gástrico es un fluído cuya finalidad es la digestión de los alimentos, tiene un pH alrededor de 1,5. Cuando, debido a las reacciones, se liberan una cantidad excesiva de hidronio H3O+, puede causar molestias, llamadas acidez de estómago, que se neutralizan con antiácidos con bases como por ejemplo: Bicarbonato de sodio (NaHCO3), carbonato de calcio (Mg(OH)3, carbonato de mangnesio (MgCO3) entre otros.
Océano
Parte de la regulación del clima del planeta viene por la absorción del CO2 que hace el océano. La absorción de CO2 por parte del océano implicaría una acidificación del mismo. Gracias al equilibrio en el océano entre el CO2 absorbido, (que se convierte en ácido carbónico), y los carbonatos, se genera un equilibrio en la reacción ácido-base, que mantiene el pH del océano en valores constantes (cercanos a 8). Una acidificación excesiva del océano implicaría prácticamente el final de la vida en el océano y por tanto de la vida en el planeta.
Acidez y basicidad en la Escala de pH
La acidez y la basicidad son conceptos relacionados con la concentración de iones de hidrógeno (H⁺) en una solución acuosa, y se miden utilizando la escala de pH.
Basicidad
- La basicidad se refiere a la cantidad de iones hidroxilo (OH⁻) presentes en una solución. Cuanto mayor sea la concentración de OH⁻, más básica será la solución.
- En la escala de pH, las soluciones básicas tienen valores de pH superiores a 7. Cuanto mayor sea el valor de pH, más básica será la solución. Por ejemplo, una solución con un pH de 10 es más básica que una solución con un pH de 8.
- La acidez se refiere a la cantidad de iones de hidrógeno (H⁺) presentes en una solución. Cuanto mayor sea la concentración de H⁺, más ácida será la solución.
- En la escala de pH, las soluciones ácidas tienen valores de pH inferiores a 7. Cuanto menor sea el valor de pH, más ácida será la solución. Por ejemplo, una solución con un pH de 2 es más ácida que una solución con un pH de 4.
Teorías Ácido- Base Bronsted-Lowry
La teoría ácido-base de Brønsted-Lowry es una de las teorías más importantes en la química que describe la acidez y la basicidad en términos de la transferencia de protones (iones de hidrógeno, H⁺). Según esta teoría, un ácido es una sustancia que puede donar un protón (H⁺), y una base es una sustancia que puede aceptar un protón. Aquí hay una explicación de cómo se aplica la teoría de Brønsted-Lowry a la acidez y la basicidad
En el contexto de la teoría de Brønsted-Lowry, se produce una reacción ácido-base cuando un ácido dona un protón a una base. La transferencia de protones resulta en la formación de una nueva especie química. Por ejemplo, en la reacción entre el ácido clorhídrico (HCl) y el ion hidróxido (OH⁻):
Base de Brønsted-Lowry
- Una base, según la teoría de Brønsted-Lowry, es una sustancia que puede aceptar un protón (H⁺) de otra sustancia. Es capaz de formar un enlace con un protón.
- Ejemplos de bases de Brønsted-Lowry incluyen el ion hidróxido (OH⁻) y el ion amonio (NH₄⁺). Estas sustancias son capaces de aceptar protones para formar enlaces químicos.
Ácido de Brønsted-Lowry
- Un ácido, en el contexto de esta teoría, es una sustancia que tiene un protón (H⁺) que puede donar a otra sustancia. En otras palabras, un ácido es una especie química que puede liberar H⁺.
- Ejemplos de ácidos de Brønsted-Lowry incluyen el ácido clorhídrico (HCl) y el ácido acético (CH₃COOH). Cuando estos ácidos se disuelven en agua, liberan protones H⁺.
Acidez
- Los compuestos orgánicos con hidrógenos ácidos (por ejemplo, grupos hidroxilo, carboxilo o amino) pueden liberar protones en reacciones químicas. Estos grupos son ácidos de Brønsted-Lowry en química orgánica.
- Ejemplo: El ácido acético (CH₃COOH) es un ácido orgánico común en el vinagre. El grupo carboxilo (-COOH) en esta molécula puede donar un protón para formar el ion acetato (CH₃COO⁻) en reacciones ácido-base.
conductividad eléctrica
La capacidad que tiene una sustancia o material para permitir el paso de corriente eléctrica a través de sí. tipos de conductividad:
- conductividad en agua
- conductividad en metales
- conductividad en suelo
características (ácidos)
Actúan como conductores de corriente eléctrica
suelen ser solubles al agua
Tienen capacidad para destruir tejidos orgánicos
El pH de los ácidos oscila entre 0 y 7 (donde 7 es neutro).