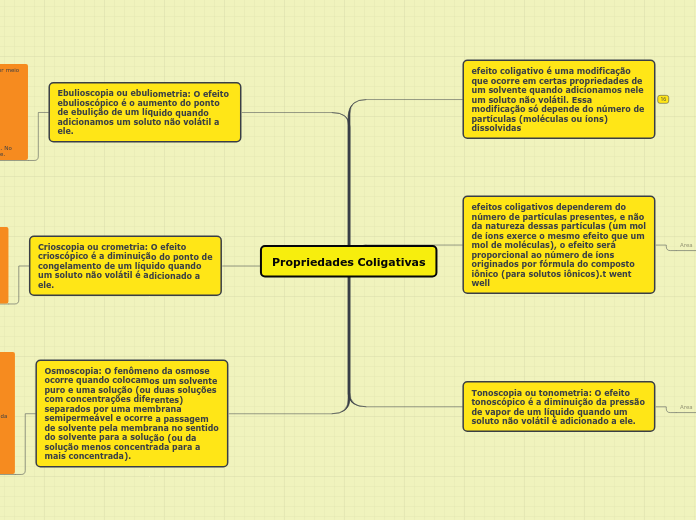
Propriedades Coligativas
Type in the name of the project that is under review, and press Enter.
Osmoscopia: O fenômeno da osmose ocorre quando colocamos um solvente puro e uma solução (ou duas soluções com concentrações diferentes) separados por uma membrana semipermeável e ocorre a passagem de solvente pela membrana no sentido do solvente para a solução (ou da solução menos concentrada para a mais concentrada).
A pressão osmótica (π) pode ser calculada por meio da fórmula:
Soluções moleculares: π = M . R . T
Soluções iônicas: π = M . R . T . i
Em que:
M = concentração em quantidade de matéria (molaridade) da solução (mol/L);
R = constante universal dos gases perfeitos, que é igual a 0,082 atm . L. mol-1. K-1 ou 62,3 mm Hg L. mol-1. K-1;
T = temperatura absoluta, dada em Kelvin;
i = fator de Van’t Hoff.
The objectives of the review should be explained to participants and kept in mind during the review.
Add an objective after reviewing your project.
i = fator de Van’t Hoff.
T = temperatura absoluta, dada em Kelvin;
R = constante universal dos gases perfeitos, que é igual a 0,082 atm . L. mol-1. K-1 ou 62,3 mm Hg L. mol-1. K-1;
M = concentração em quantidade de matéria (molaridade) da solução (mol/L);
Soluções iônicas: π = M . R . T . i
Soluções moleculares: π = M . R . T
A pressão osmótica (π) pode ser calculada por meio da fórmula:
Crioscopia ou crometria: O efeito crioscópico é a diminuição do ponto de congelamento de um líquido quando um soluto não volátil é adicionado a ele.
A diminuição do ponto de congelamento pode ser calculado por meio da fórmula:
Soluções moleculares: ΔtC = KC. W
Soluções iônicas: ΔtC = KC. W . i
Em que:
ΔtC = diminuição do ponto de congelamento;
KC = constante crioscópica.
Who should take part in the project review?
Consider:
- Customer representatives
- User representatives
- Project managers
- Team members
- Quality Assurance staff
Add a participant.
KC = constante crioscópica.
ΔtC = diminuição do ponto de congelamento;
Em que:
Soluções moleculares: ΔtC = KC. WSoluções iônicas: ΔtC = KC. W . i
A diminuição do ponto de congelamento pode ser calculado por meio da fórmula:
Ebulioscopia ou ebuliometria: O efeito ebulioscópico é o aumento do ponto de ebulição de um líquido quando adicionamos um soluto não volátil a ele.
O aumento do ponto de ebulição pode ser calculado por meio da fórmula:
Soluções moleculares: ΔtE = KE. W
Soluções iônicas: ΔtE = KE. W . i
Em que:
ΔtE = elevação do ponto de ebulição;
KE = constante ebulioscópica;
W = molalidade (massa molecular do solvente / 1000). No caso de soluções aquosas diluídas, é igual à molaridade.
Tonoscopia ou tonometria: O efeito tonoscópico é a diminuição da pressão de vapor de um líquido quando um soluto não volátil é adicionado a ele.
Add an area that could have gone better, and which could be improved in future projects.
Soluções moleculares: ΔP/P2 = Kt . M
Soluções iônicas: ΔP/P2 = Kt . M . i
Em que:
ΔP/P2 = abaixamento relativo da pressão máxima de vapor;
ΔP = abaixamento absoluto da pressão máxima de vapor;
P2 = pressão de vapor do solvente;
Kt = constante tonoscópica;
M = concentração em mol/L (em quantidade de matéria da solução);
i = fator de Van't Hoff.
Problem
Add some notes about what went wrong with the project.
Was it:
- Late?
- Over budget?
- Not doing the right thing?
- Unreliable or faulty?
- The source of more problems later?
efeitos coligativos dependerem do número de partículas presentes, e não da natureza dessas partículas (um mol de íons exerce o mesmo efeito que um mol de moléculas), o efeito será proporcional ao número de íons originados por fórmula do composto iônico (para solutos iônicos).t went well
Area
Add an area that performed well, that the team was proud of and that you would like to repeat on future projects.
Soluto
é normalmente, o componente de uma solução que é dissolvido por um solvente.
What changes could be made to processes and methods to ensure that the success of the project can be repeated in future projects?
Think about:
- Project management and planning
- Risk assessments
- Project communication
- Requirements management
- Processes that you had to vary on this occasion
- Change control
- Testing
Solvente
é normalmente, o componente – líquido – de uma solução que dissolve um soluto.
What role did processes play?
- What role did agreed processes and methods play in the success of the project?
- Did they help in achieving a good outcome?
- Or did you succeed by bending processes and rules?
Solução
São misturas homogêneas em que uma substância (em estado sólido, líquido – e até mesmo gasoso) é dissolvida num líquido.
Add indicators that will show how the project will go.
- Were there any advance signs that the project would go well?
- Which usual signs of trouble were absent?
- Were there early warning signs which were picked up and successfully dealt with?
Compostos iônicos
quando em solução, apresentaram o número de partículas dispersas, iguais à quantidade molar dos íons dissolvidos.
Add some notes about the reasons for the success of the project.
Was it due to:
- Skills and knowledge?
- Good planning?
- Good information?
- Good processes and tools?
- Good luck (no surprise problems)?
- Other reasons?
Compostos moleculares
quando em solução, apresentaram o número de partículas dispersas, iguais à quantidade molar dos compostos dissolvidos.
Subtópico
Success
Add some notes about what went well with the project.
Was it:
- On time?
- On a budget?
- Meeting requirements perfectly?
- Reliable and well-executed?
- Strategic and well-integrated?
efeito coligativo é uma modificação que ocorre em certas propriedades de um solvente quando adicionamos nele um soluto não volátil. Essa modificação só depende do número de partículas (moléculas ou íons) dissolvidas
Quality
Add some information about the quality performance of your project.
- Did you have a quality plan for your project?
- Did you use formalized processes or methods during the project?
- Did you verify designs against requirements?
- Did you validate deliverables against designs and requirements?
- What proportion of defects could have been foreseen and designed out earlier?
- What was the overall impact of rework or redesign on the project?
Risks
Risk
Add some information about the risk performance of your project.
- Did you keep a log of potential risks?
- Did you take action to control risks?
- How many of the identified risks actually occurred? Were you able to control their impact?
- How many problems arose which had not been identified as risks? Could some of these have been predicted?
Changes
Impact
Add some information about the impact of change in your project.
- Did you keep a log of changes?
- Did you use a change control method in your project?
- What were the origins of changes in your project? Did they come from the customer, from clarified specifications, or from unexpected issues?
- Did you have to make changes to the original scope to meet other constraints?
Deliverables
Output
Add some information about the performance of deliverables.
- Did the project plan define deliverables?
- Were the deliverables completed on time?
- Did you have defined acceptance criteria?
- What was the initial acceptance rate?
- Was further work needed to bring deliverables up to the required level? What impact did this have on the project?
Requirements
Requirement
Add some information about performance against requirements.
- Did you have a set of requirements at the start of the project?
- How clear were these requirements?
- How well were you able to meet these requirements?
- Did the requirements change during the project?
- Was there any impact from changing requirements?
- Were changing requirements identified as a project risk?
Timescales
Timescale
Add some information about the timescale performance of the project.
- Did you have a plan with dated milestones?
- Did you achieve the milestone dates?
- Did you need to make changes to keep to the plan?
- What were the reasons for running late or ahead?
Budget
Financial
Add some information about the financial performance of the project.
- Did you have a planned budget?
- How close to the budget was it?
- Did you need to make some changes to keep it within budget?
- What were the reasons for going under or over budget?
Communications
Information
Add some information about the performance of the communication inside the project.
- Did you have a communications plan?
- Did all project stakeholders know enough about the project at the right times?
- Could the project participants find the information they needed, in the expected places?
- Did the project stakeholders provide all the information and feedback needed?