Stabilité de l'atome
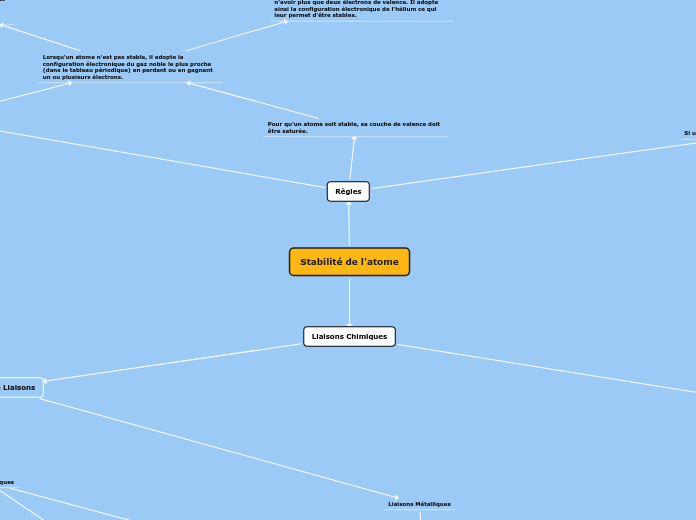
Liaisons Chimiques
Représentation de la molécule formée :
Le modèle de Lewis.
Type de liaison
Liaison ionique
Les ions liés sont représentés côte à côte par leur symbole, avec leur charge indiquée en exposant. Leurs électrons de valence après don et réception sont représentés par des points autour de l'élément chimique.
Liaison covalente
Partage d'électrons de valence
représenté par des traits reliant les éléments.
Si deux électrons partagé : double trait =
Si un électron partagé : un seul trait -
Exemple de la molécule d'eau, créée suite à la liaison covalente entre un atome d'oxygène et deux atomes d'hydrogène :
H-O-H
Exemple de la molécule de chlorure de sodium, formée suite à la liaison ionique entre un atome de chlore et un atome de sodium :
. .
Na+ : Cl-:
¨
Eléments chimiques
représentés leur symbole :
Hélium = He.
Types de Liaisons
Liaisons Métalliques
Cations métalliques entourés d'un volume d'électrons mobiles.
Cette mer d'électrons dans laquelle baignent des cations forment des métaux, comme on les trouve dans la nature.
Les électrons ne sont pas rattachés à leur atome d'origine. Si un électron s'en éloigne, il est remplacé par un autre.
Liaisons Ioniques
Forment des composés ioniques.
Assemblage en structure en trois
dimensions : le cristal ionique.
Doit respecter l'électroneutralité
des éléments.
Un atome, généralement un métal, donne
un ou plusieurs électrons à un autre,
généralement un non-métal.
Suite au changement du nombre
d'électrons, les atomes deviennent
des ions.
Equilibrage des charges négatives
des anions (élément non-métal) et
positives des cations (élément métal).
Liaisons Covalentes
Forment des molécules
Partage des
électrons de valence.
Permet le respect de la règle
de l'octet ou du duet, et donc
la stabilité des éléments chimiques.
Liaison entre deux
atomes non stables.
Règles
Si un atome n'est pas stable, il ne peut pas exister.
Les gaz nobles sont stables par défaut
car leur couche externe est déjà saturée.
Lorsqu'un atome n'est pas stable, il adopte la configuration électronique du gaz noble le plus proche (dans le tableau périodique) en perdant ou en gagnant un ou plusieurs électrons.
Règle de l'octet :
Les éléments chimiques (sauf ceux proches de l'hélium) perdent ou gagnent un ou plusieurs électrons, afin d'adopter la configuration électronique du gaz noble le plus proche. Pour cela il ne doivent avoir que 8 électrons de valence. Cela leur permet ainsi d'être stables.
Règles du duet :
Les éléments chimiques proches de l'hélium (He) perdent ou gagnent un ou plusieurs électrons afin de n'avoir plus que deux électrons de valence. Il adopte ainsi la configuration électronique de l'hélium ce qui leur permet d'être stables.
Pour qu'un atome soit stable, sa couche de valence doit être saturée.