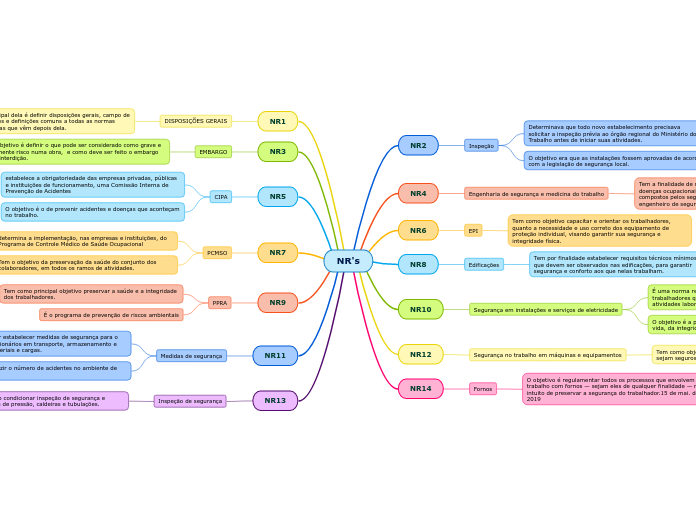
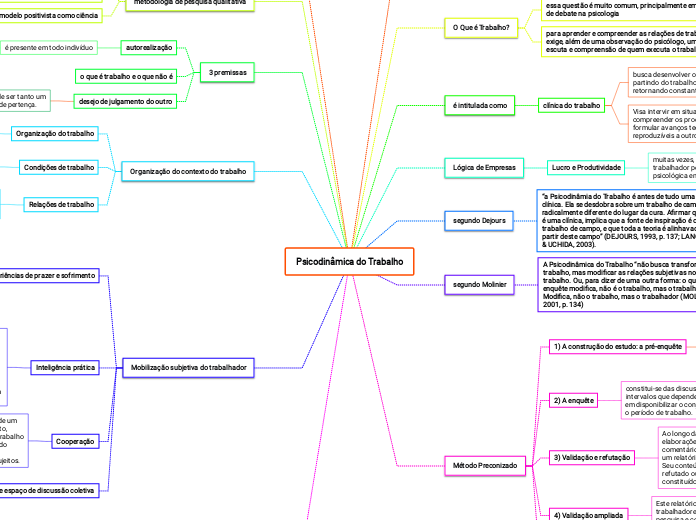
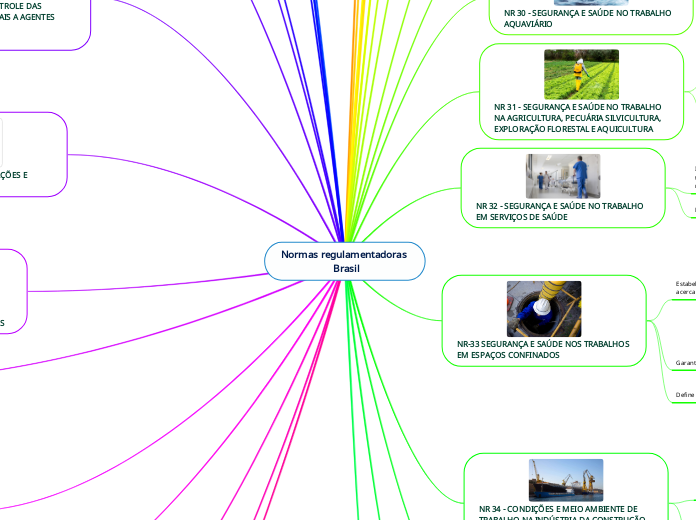
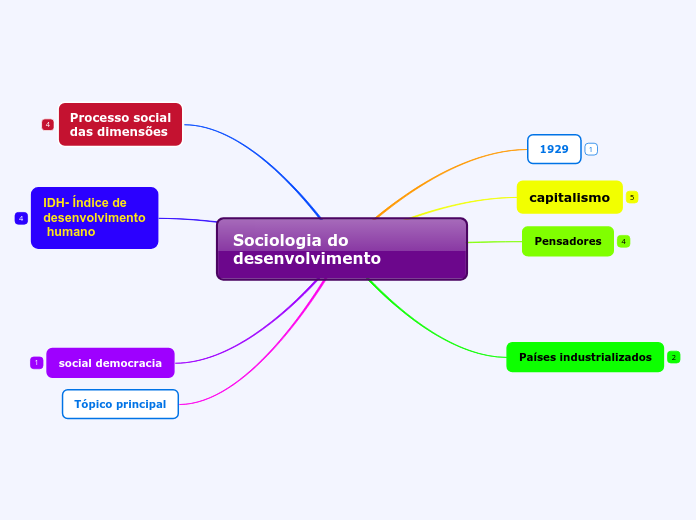
por Sara Santos 9 anos atrás
946
Teste 1
Chuvas ácidas são um problema ambiental agravado por atividades humanas, como emissões industriais e veículos a diesel. Para mitigar esse fenômeno, é crucial incentivar o uso de transportes coletivos e promover a substituição de frotas poluentes por alternativas mais ecológicas.