por Martha Estalla Catari 4 anos atrás
1080
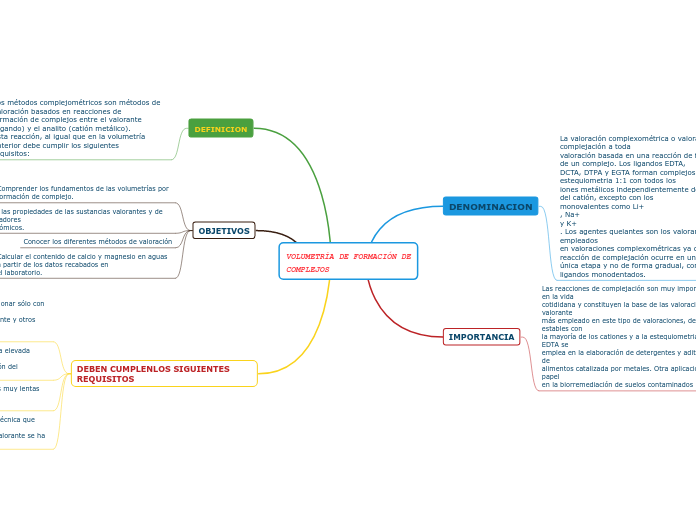
VOLUMETRÍA DE FORMACIÓN DE COMPLEJOS
La formación de complejos químicos juega un papel crucial en diversos campos científicos y en aplicaciones cotidianas, particularmente en las valoraciones complejométricas. Estas reacciones se utilizan comúnmente para determinar la cantidad de ciertos iones en una muestra, siendo el EDTA uno de los agentes valorantes más empleados debido a su capacidad para formar complejos estables con una amplia gama de cationes.