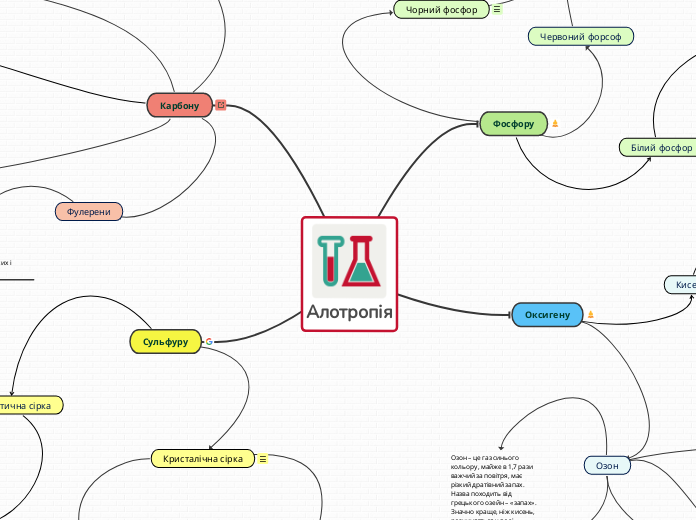
Алотропія властива не всім
неметалічним хімічним
елементам
Наприклад, Гідроген, Нітроген, елементи VIIA і VIIIA груп не мають алотропних модифікацій, тобто кожен із цих елементів утворює лише одну просту речовину
Алотропія
Сульфуру
Кристалічна сірка
Ромбічна форма
При кімнатній температурі Сульфур
перебуває у вигляді α-сірки, що являє
собою жовті крихткі кристали без
запаху, нерозчинні у воді. Якщо
молекули розташовані щільно, то це
-алотропна форма ромбічної сірки.
Моноклінна форма
За температур вище відбувається повільне
перетворення α-сірки в β-сірку, що є майже
білими кристалічними пластинками. Менш
щільне упакування молекул спричинює
виникнення-алотропної форми моноклітинної
сірки.
Пластична сірка
Якщо сірку розплавити й швидко
охолодити, утворюється третя
алотропна форма: пластична
сірка — коричнева гумоподібна
маса. Їй можна надати будь-якої
форми. Це пояснюється тим, що
сірка не містить молекул S8, а
складається з довгих ланцюжків
атомів Сульфуру.
Карбону
Фулерени
Були відкриті у 1985 році групою американських і британський учених
Фулерени — це тверді
кристалічні речовини, які на
відміну від інших алотропних
модифікацій, розчиняються в
органічних розчинниках з
утворенням яскраво забарвлених
розчинів. Молекули фулеренів
являють собою сфери або
еліпсоїди.
Графен
Двовимірна структура, утворена шаром атомів Карбону завтовшки в один атом
За певними оцінками графен
має велику механічну міцність
та рекордно велику
теплопровідність і рухомість
електронів. Він має перспективи
застосування в наноелектроніці
та, можливо, замінить силіцій у
комп'ютерних мікросхемах
Графіт
Графіт є темно-сірою
речовиною з металічним
блиском, жирний на дотик. На
відміну від алмазу, графіт
непрозорий, проводить
електричний струм і залишає
сірий слід на папері. Графіт має
дуже високу температуру
плавлення (3700 °С).
Алмаз
Завдяки будові алмаз —
найтвердіша з усіх відомих
природних речовин. Усі чотири
валентних електрони кожного
атома Карбону беруть участь в
утворенні зв'язків, тому алмаз не
проводить електричний струм.
Це безбарвна прозора
кристалічна речовина, добре
заломлює світло.
Алмаз і графіт можуть
взаємоперетворюватися. При
сильному нагріванні без доступу
повітря алмаз чорніє і
перетворюється на графіт.
Графіт можна перетворити на
алмаз при високій температурі і
великому тиску.
Карбін
Він має лінійну
будову:
=C=C=C=C=C= або −C≡C−C≡C−.
Карбін за фізичними
властивостями схожий на графіт
і іноді трапляється в ньому у
вигляді білих прожилок. Карбін
володіє напівпровідниковими
властивостями.
Оксигену
Озон
Він затримує шкідливе для людини
ультрафіолетове випромінювання
Сонця, поглинає інфрачервоні промені
Землі, перешкоджаючи її остиганню.
Молекула озону нестійка, досить легко
розпадається:
2О3 → 3О2
Озон значно сильніший
окисник, ніж навіть кисень. Він
окиснює чимало речовин, які не
окиснює кисень, наприклад
срібло та ртуть:
8 Ag + 2 O3→ 4Ag2O+ O2
Озон використовують для
очищення питної води,
дезінфекції повітря. Повітря
хвойних лісів корисне, тому що
озон утворюється в процесі
окиснення смоли хвойних
дерев.
У природі озон утворюється з кисню
під час грозових розрядів, а на висоті
10-30 км – під дією ультрафіолетового
випромінювання.
3О2 → 2О3
Озон – це газ синього кольору, майже в 1,7 рази важчий за повітря, має різкий дратівний запах. Назва походить від грецького озейн – «запах». Значно краще, ніж кисень, розчиняється у воді. Токсичний, надзвичайно сильний окисник.
Кисень
Кисень – безбарвний газ, трохи важчий за повітря, без запаху, дуже погано розчиняється у воді.
Ця алотропна модифікація
Оксигену відіграе важливу роль
y процесах дихания, горіння,
обміну речовин
та енергії, виробництві металів
тощо.
Поширена в
природі речовина. Достатньо
пригадати, що повітря на 1/5
екладається з
нього.
Фосфору
Червоний форсоф
Червоний фосфор не отруйний і в
сірковуглеці не розчиняється. Густина
його 2,20 г/см³. Запалюється червоний
фосфор лише при температурі 240°С.
При нагріванні він не плавиться, а
переходить безпосередньо з твердого в
газоподібний стан (сублімує). При
охолодженні пари фосфору переходять
у білий фосфор.
Являє собою порошкоподібну речовину червоно-бурого кольору. Утворюється при тривалому нагріванні білого фосфору в герметично закритому посуді при температурі близько 250°С
Чорний фосфор
Речовина, схожа на графіт, має шарувату будову. Він масний на дотик, з металічним блиском, виявляє властивості напівпровідників.
Речовина, схожа на графіт, має шарувату будову. Він масний на дотик, з металічним блиском, виявляє властивості напівпровідників.
Утворюється також з білого
фосфору при тривалому
нагріванні (200ºС) під великим
тиском (1220 МПа).
Білий фосфор
Являє собою безбарвну
воскоподібну речовину з
жовтуватим відтінком, через що
його називають також жовтим
фосфором. Утворюється при
швидкому охолодженні пари
фосфору. У воді практично не
розчиняється, але добре
розчиняється в сірковуглеці CS2
Білий фосфор надзвичайно отруйний
— на шкірі залишає хворобливі опіки.
Доза його в 0,1 г — смертельна для
людини.На повітрі білий фосфор
легко окислюється. При цьому
частина хімічної енергії
перетворюється в світло. Тому білий
фосфор у темряві світиться. Білий
фосфор — легкозаймиста речовина.
Температура його займання 40°С, а в
дуже роздрібненому стані він
самозаймається на повітрі навіть при
звичайній температурі. Тому білий
фосфор зберігають під водою.