av Прокоф'єва Марія för 2 årar sedan
242
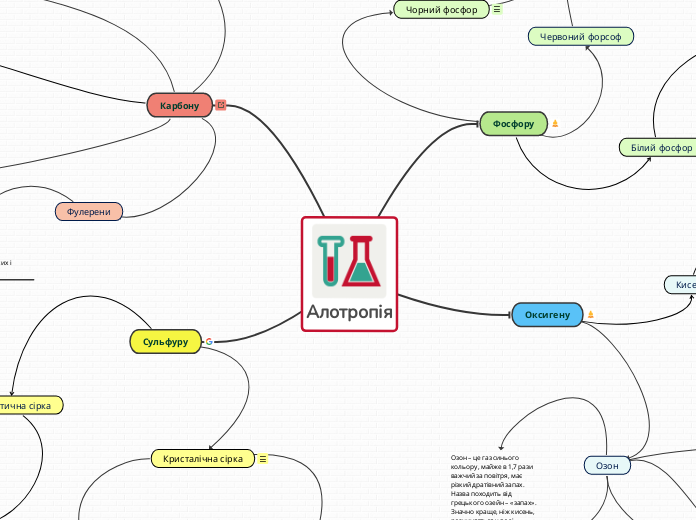
Алотропія
Не всі неметалічні елементи володіють алотропними формами. Наприклад, гідроген, нітроген, а також елементи VIIA і VIIIA груп не мають алотропних модифікацій і формують лише одну просту речовину.
av Прокоф'єва Марія för 2 årar sedan
242

Mer av detta
При кімнатній температурі Сульфур перебуває у вигляді α-сірки, що являє собою жовті крихткі кристали без запаху, нерозчинні у воді. Якщо молекули розташовані щільно, то це -алотропна форма ромбічної сірки.
За температур вище відбувається повільне перетворення α-сірки в β-сірку, що є майже білими кристалічними пластинками. Менш щільне упакування молекул спричинює виникнення-алотропної форми моноклітинної сірки.
Фулерени — це тверді кристалічні речовини, які на відміну від інших алотропних модифікацій, розчиняються в органічних розчинниках з утворенням яскраво забарвлених розчинів. Молекули фулеренів являють собою сфери або еліпсоїди.
За певними оцінками графен має велику механічну міцність та рекордно велику теплопровідність і рухомість електронів. Він має перспективи застосування в наноелектроніці та, можливо, замінить силіцій у комп'ютерних мікросхемах
Завдяки будові алмаз — найтвердіша з усіх відомих природних речовин. Усі чотири валентних електрони кожного атома Карбону беруть участь в утворенні зв'язків, тому алмаз не проводить електричний струм. Це безбарвна прозора кристалічна речовина, добре заломлює світло.
Алмаз і графіт можуть взаємоперетворюватися. При сильному нагріванні без доступу повітря алмаз чорніє і перетворюється на графіт. Графіт можна перетворити на алмаз при високій температурі і великому тиску.
Карбін за фізичними властивостями схожий на графіт і іноді трапляється в ньому у вигляді білих прожилок. Карбін володіє напівпровідниковими властивостями.
Являє собою порошкоподібну речовину червоно-бурого кольору. Утворюється при тривалому нагріванні білого фосфору в герметично закритому посуді при температурі близько 250°С
Речовина, схожа на графіт, має шарувату будову. Він масний на дотик, з металічним блиском, виявляє властивості напівпровідників.
Утворюється також з білого фосфору при тривалому нагріванні (200ºС) під великим тиском (1220 МПа).
Білий фосфор надзвичайно отруйний — на шкірі залишає хворобливі опіки. Доза його в 0,1 г — смертельна для людини.На повітрі білий фосфор легко окислюється. При цьому частина хімічної енергії перетворюється в світло. Тому білий фосфор у темряві світиться. Білий фосфор — легкозаймиста речовина. Температура його займання 40°С, а в дуже роздрібненому стані він самозаймається на повітрі навіть при звичайній температурі. Тому білий фосфор зберігають під водою.