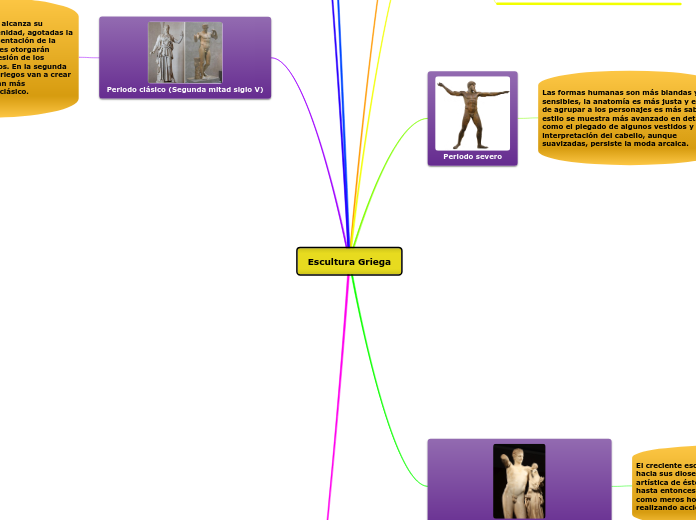
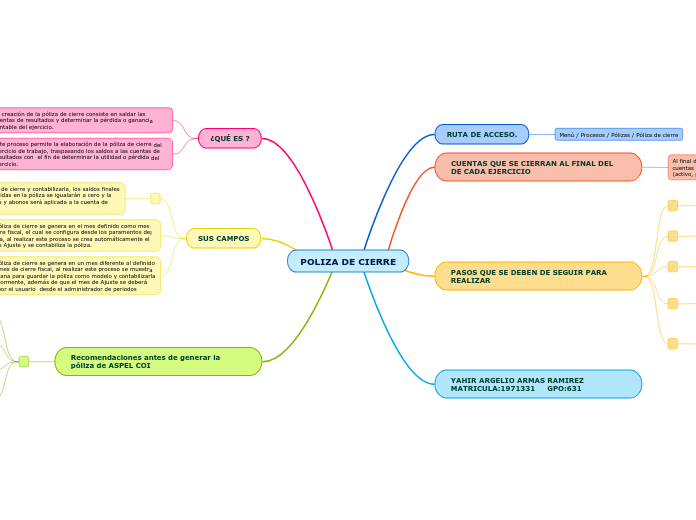
realizată de Ricardo Rodríguez Salamanca 6 ani în urmă
297
Aplicación de las matemáticas en la estequiometría
La estequiometría es una rama fundamental en la química que implica el cálculo de las cantidades de reactivos y productos en una reacción química. Un concepto crucial es la pureza de los reactivos, ya que los cálculos deben realizarse solo con la parte pura de la sustancia.