realizată de Sandra Paola Fonseca Acosta 3 ani în urmă
202
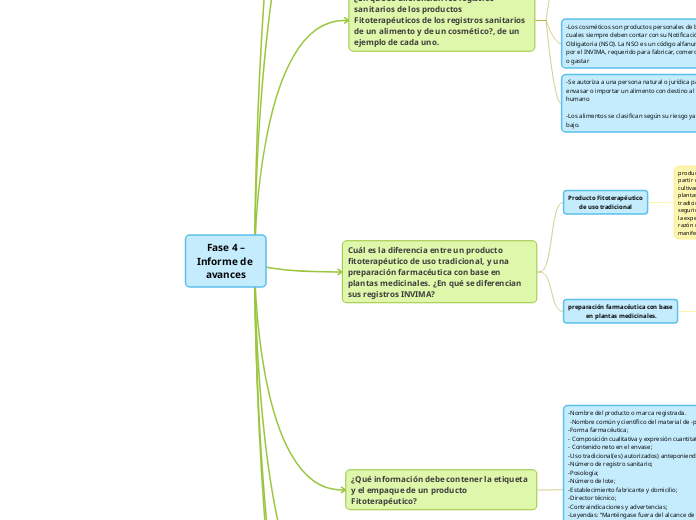
Fase 4 – Informe de avances
Los medicamentos son productos fabricados a partir de diversas sustancias químicas, algunas de origen biológico como la penicilina, y otros a través de ingeniería biológica que involucra la introducción de genes en bacterias.