Fase 4 –
Informe de avances
Bibliografía
Ministerio de la Protección Social. (2018). Decreto 1156 de 2018. Por el cual se reglamenta el régimen de registro sanitario de productos fitoterapéuticos y se dictan otras disposiciones. http://es.presidencia.gov.co/normativa/normativa/DECRETO%201156%20DEL%2006%20DE%20JULIO%20DE%202018.pdf
Ministerio de Protección Social. (2009). Resolución número 000126 de 2009. Por la cual se establecen las condiciones esenciales para la apertura, funcionamiento, vigilancia y control sanitario de las tiendas naturistas y se dictan otras disposiciones. https://www.minsalud.gov.co/sites/rid/Lists/BibliotecaDigital/RIDE/DE/DIJ/Resoluci%C3%B3n%200126%20de%202009.pdf
DECRETO 2266 DE 2004
. (julio 15)
. Por el cual se reglamentan los regímenes de registros sanitarios, y de vigilancia y control sanitario y publicidad de los productos fitoterapéuticos.
https://www.suin-juriscol.gov.co/viewDocument.asp?ruta=Decretos/1428240#:~:text=por%20el%20cual%20se%20reglamentan,publicidad%20de%20los%20productos%20fitoterap%C3%A9uticos.&text=Art%C3%ADculo%201%C2%B0%20Ambito%20de%20aplicaci%C3%B3n.
¿Qué entidad tiene la responsabilidad de realizar el control y vigilancia a las
tiendas naturistas?
La Vigilancia y control, le corresponde a las secretarías departamentales, distritales y municipales de categoría especial 1°, 2° y 3° ejercer la vigilancia y control para el cumplimiento de lo dispuesto en la presente resolución 000126 DE 2009, e informar al Invima oportunamente acerca de las anomalías que se presenten.
Según la resolución 000126, ¿cuál es el procedimiento que debe ser aplicado
para el reporte de un incidente adverso
Cuando el personal responsable del establecimiento tenga
información del usuario de la presentación de un incidente adverso ocurrido asociado con una utilidad terapéutica que hay a sido vendido en su
establecimiento, comunicará en forma escrita a la autoridad sanitaria competente que le autorizó la apertura y
funcionamiento reportando lo siguiente:
La autoridad sanitaria comunicará dicha información al Instituto Nacional de Vigilancia de Medicamentos y
Alimentos –Invima– quien la verificará y realizará el estudio pertinente y clasificará el incidente presentado
Información del incidente: Anotar las situaciones comunicadas por el usuario sobre el evento presentado, si el usuario requirió de asistencia médica en nombre del centro o institución de salud donde fue atendido y la
dirección.
Información general del producto: Nombre del producto, número de lote, laboratorio fabricante, nombre y dirección del distribuidor, fecha de vencimiento del producto y registro sanitario.
¿Qué información debe contener la etiqueta y el empaque de un producto
Fitoterapéutico?
-Nombre del producto o marca registrada.
-Nombre común y científico del material de -planta medicinal;
-Forma farmacéutica;
- Composición cualitativa y expresión cuantitativa en peso del material vegetal utilizado.
- Contenido neto en el envase;
-Uso tradicional(es) autorizados) anteponiendo la expresión “este producto tradicionalmente ha sido utilizado para ...”;
-Número de registro sanitario;
-Posología;
-Número de lote;
-Establecimiento fabricante y domicilio;
-Director técnico;
-Contraindicaciones y advertencias;
-Leyendas: “Manténgase fuera del alcance de los niños.” “Si los síntomas persisten, consulte a su médico.” “No consumir dosis superiores a las indicadas.” Usar bajo supervisión médica durante el embarazo y lactancia.”, “Este producto está contraindicado en embarazo y niños menores de doce años”;
-Leyenda para el consumidor: Este producto está dirigido a tratar el efecto sintomático, no es curativo, por tanto no se podrá suspender el tratamiento sugerido por el médico;
-La información adicional que a juicio técnico de la Sala Especializada de Productos Naturales o quien haga sus veces de la Comisión Revisora, considere necesaria.
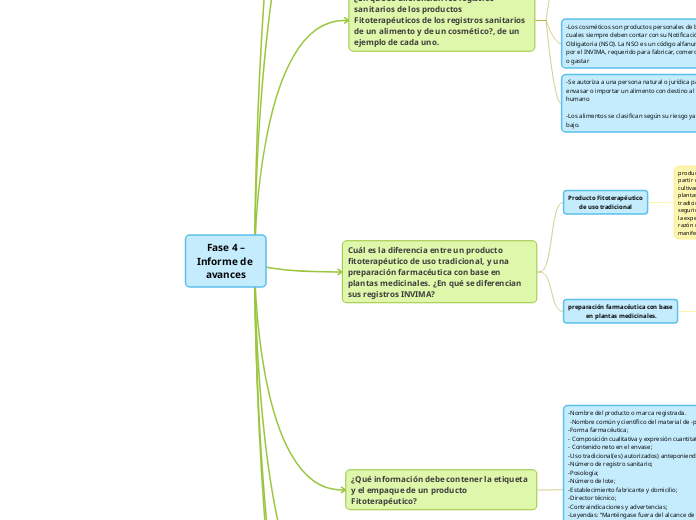
Cuál es la diferencia entre un producto fitoterapéutico de uso tradicional, y una preparación farmacéutica con base en plantas medicinales. ¿En qué se diferencian sus registros INVIMA?
preparación farmacéutica con base
en plantas medicinales.
Es el producto
fitoterapéutico elaborado a partir de material de la planta medicinal, o preparados de la misma, a la cual se le ha comprobado actividad terapéutica y s~guridad farmacológica y que está incluido en las normas farmacológicas colombianas o en el listado de plantas medicinales para productos fitoterapéuticos de la categoría preparaciones farmacéuticas con base en plantas medicinales.
Parala obtención del registro sanitario de las preparaciones farmacéuticas con base en plantas medicinales (PFM) incluidas en el listado de plantas medicinales aceptadas con fines terapéuticos para productos fitoterapéuticos de la categoría preparaciones farmacéuticas con base en plantas medicinales
Las preparaciones farmacéuticas con base en
plantas medicinales -PFM deben cumplir:
- Estar incluidos en el listado de plantas medicinales aceptadas con fines terapéuticos de la categoría de preparaciones farmacéuticas con base en plantas medicinales;
- No presentarse en formas farmacéuticas inyectables;
- No presentarse en formas farmacéuticas en las que se requiera esterilidad, salvo las preparaciones oftálmicas; y,
- No combinarse el material de la planta medicinal con sustancias activas aisladas y químicamente definidas.
Producto Fitoterapéutico
de uso tradicional
producto fitoterapéutico de fabricación nacional elaborado a partir de material de planta medicinal o asociaciones entre sí cultivadas en nuestro país y que esté incluido en el listado de plantas medicinales para productos fitoterapéuticos de uso tradicional, en las formas farmacéuticas aceptadas cuya eficacia y seguridad, aún sin haber realizado estudios clínicos, se deduce de la experiencia por su uso registrado a lo largo del tiempo y, en razón de su inocuidad, está destinado para el alivio de
manifestaciones sintomáticas de una enfermedad
Los registros sanitarios de productos
fitoterapéuticos de uso tradicional se otorgarán de manera automática, siempre y cuando se encuentren incluidos en el listado de plantas medicinales de productos fitoterapéuticos de uso tradicional y cumpla con los requisitos legales y técnicos establecidos en el presente decreto 1156.
¿En qué se diferencian los registros sanitarios de los productos Fitoterapéuticos de los registros sanitarios de un alimento y de un cosmético?, de un ejemplo de cada uno.
-Se autoriza a una persona natural o jurídica para fabricar o envasar o importar un alimento con destino al consumo humano
-Los alimentos se clasifican según su riesgo ya sea alto, medio, bajo.
su vigencia es A-Alto_ con vigencia de 5 años
M-Medio: permiso sanitario con vigencia de 7 años
B-Bajo: notificación sanitaria de alimentos con vigencia de 10 años.
-Los cosméticos son productos personales de belleza, los cuales siempre deben contar con su Notificación Sanitaria Obligatoria (NSO). La NSO es un código alfanumérico expedido por el INVIMA, requerido para fabricar, comercializar, importar o gastar
La diferencia esta en la clasificación que se le dan a los productos Fitoterapéuticos los cuales pueden ser:
Preparaciones farmacéuticas con base en plantas medicinales (PFM).
Producto fitoterapéutico de uso tradicional (PFT).
Producto fitoterapéutico de uso tradicional importado (PFTI).
Modalidades de registro sanitario. se otorgará para las siguientes modalidades:
Fabricar y vender, que comprende por sí misma la posibilidad de exportar;
Importar y vender;
Importar, acondicionar y vender;
Fabricar y exportar.
Obligatoriedad del registro sanitario. Requieren para su producción, importación, exportación, procesamiento, envase, empaque, expendio y comercialización, de registro sanitario expedido por el lNVIMA para cada producto.
Identificar las diferencias entre un producto fitoterapéutico y un medicamento
Los medicamentos se fabrican mezclando una serie de sustancias químicas, otros como la penicilina son subproductos fabricados por organismos como los hongos, y unos pocos de ellos se obtienen atreves de la ingeniería biológica introduciendo genes en bacterias que se encargan de fabricar las sustancias deseadas.
Los productos Fitoterapéuticos, son preparados medicinales empacados y etiquetados, donde sus sustancias activas provienen de plantas medicinales o asociaciones de estas, presentado en estado bruto o forma farmacéutica que se usa son fines terapéuticos
¿Cuál es el objetivo y campo de aplicación del decreto 1156 y la resolución
00126?
Resol.00126, tiene por objeto establecer las condiciones esenciales que se deben cumplir para la apertura y funcionamiento de las tiendas naturistas los productos que en dichos establecimientos se pueden vender así como las disposiciones para su vigilancia y control sanitario.
Ámbito de aplicación. La presente resolución se aplicará a las tiendas naturistas que se encuentren en funcionamiento.
Dec.1156, tiene por objeto reglamentar el régimen de registro sanitario para productos fitoterapéuticos, incorporar nuevos referentes internacionales y simplificar el procedimiento para su renovación y modificación, y señalar los requisitos para su expendio.
Campo de aplicación: Personas naturales y jurídicas que desarrollen actividades de producción, importación, comercialización, almacenamiento, distribución y expendio de productos fitoterapéuticos.
- A las autoridades sanitarias que ejercen funciones de inspección, vigilancia y control.