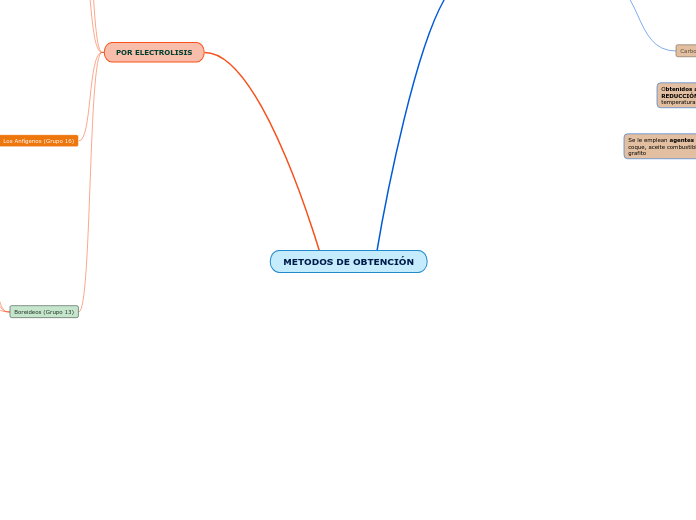
METODOS DE OBTENCIÓN
POR ELECTROLISIS
Boreideos (Grupo 13)
El aluminio se prepara por electrólisis a partir de la bauxita cuya mena es AlO3(OH).
El resto de los metales del grupo también se obtiene por electrólisis de las disoluciones acuosas de sus sales.
El boro (B) se obtiene por reducción del B2O3 con magnesio.
B2O3 + 3 Mg → 2 B + 3 MgO
No se encuentran en estado elemental, sino que suelen encontrarse formando óxidos e hidróxidos.
Los Anfígenos (Grupo 16)
El polonio se obtiene bombardeando bismuto con neutrones.
El selenio y teluro se obtienen como subproductos en la fabricación de ácido sulfúrico por el método de las cámaras de plomo formando parte de los barros anódicos.
El resto de los elementos del grupo se obtiene por reducción de los óxidos.
Oxigeno
Descomposición térmica de percloratos y cloratos
KClO4 → 2O2 + KCl KClO3 → 3/2O2 + KCl
Electrolisis del agua
2H2O → O2 + 2H2
se extrae por destilación fraccionada del aire líquido.
imagen de extraccion
formador de ácidos y bases.
Halógenos (Grupo 17)
Otros elementos del grupo
Métodos Electrolíticos y empleos de agentes oxidantes
El yodo se obtiene a partir del yodato de sodio, que se encuentra en las aguas residuales de los nitratos de Chile. Se trata con SO2 para reducir el yodato a yoduro.
El propio yoduro al reaccionar con más yodato produce yodo: 5 I– + IO3– + 6 H+ --> 3 I2 + 3 H2O.
El bromo se obtiene por oxidación de los bromuros con cloro:
2 Br– + Cl2 --> 2 Cl – + Br2.
El cloro se obtiene por electrólisis disoluciones muy concentradas de NaCl (salmueras) obteniéndose también como producto secundario el NaOH.
Flúor
Método Electrolítico
No puede oxidarse en condiciones habituales y ha de hacerlo en ausencia de agua, usando una mezcla de HF y KF y teniendo la precaución de separar los espacios del ánodo y del cátodo para evitar que el hidrógeno desprendido reaccione violentamente con el flúor obtenido.
El astato es muy raro, ya que es producto intermedio de las series de desintegración radiactiva.
No se encuentran libres en la naturaleza, sino formando haluros de metales alcalinos y alcalinotérreos.
Metales Alcalinos (GRUPO 1)
Hay que reducirlos para obtenerlos en estado puro. Dado que son muy reductores hay que acudir a la electrólisis.
la del hidróxido de potasio fundido para obtener potasio e hidrógeno en el cátodo, mientras se obtiene oxígeno en el ánodo.
2 KOH(l) --> 2 K(l) + H2(g) + O2(g).
La electrólisis del cloruro de sodio fundido para obtener sodio en el cátodo.
2 NaCl(l) --> Na(l) + Cl2(g).
POR REDUCCION DIRECTA
Carbonoideos (Grupo 14)
Obtenidos a través de HORNOS DE REDUCCIÓN DIRECTA a gran temperatura.
Se le emplean agentes reactivos reductores gas natural, coque, aceite combustible, monóxido de carbono, hidrógeno o grafito
Nitrogenoideos (Grupo 15)
Otros elementos P, As, Sb, Bi.
Se obtiene a partir de reducción con coque en hornos
El nitrógeno
También puede obtenerse por calentamiento del nitrito de amonio.
NH4NO2(s) --> 2 H2O(g) + N2(g).
En el laboratorio se obtiene por oxidación del amoniaco con óxido de cobre (II)
2 NH3(g) + 3 CuO(s) --> 3 Cu(s) + 3 H2O(g) + N2(g)
Obtiene a partir del aire por licuación de éste y posterior destilación fraccionada.
A veces se presentan nativos pero lo más habitual es encontrarlos como óxidos o sulfuros.
Metales Alcalinotérreos (grupo 2)
Existen dos métodos fundamentales de obtención
Por reducción de sus óxidos con carbono: MO(s) + C(s) --> M(s) + CO(g).
Electrólisis de sus haluros fundidos: MX2(l) --> M(l) + X2(g).
Al igual que los metales alcalinos no existen en estado libre debido a su actividad química.