OXALATO DE SODIO
Es una disolución
RESULTADO: D- GALACTOSA
Fórmula: C6H12O6
Densidad: 1,732 g/ml
Punto de fusión: 167ºC
Reductor
Destrógiro
Fuente:
https://es.wikipedia.org/wiki/Galactosa
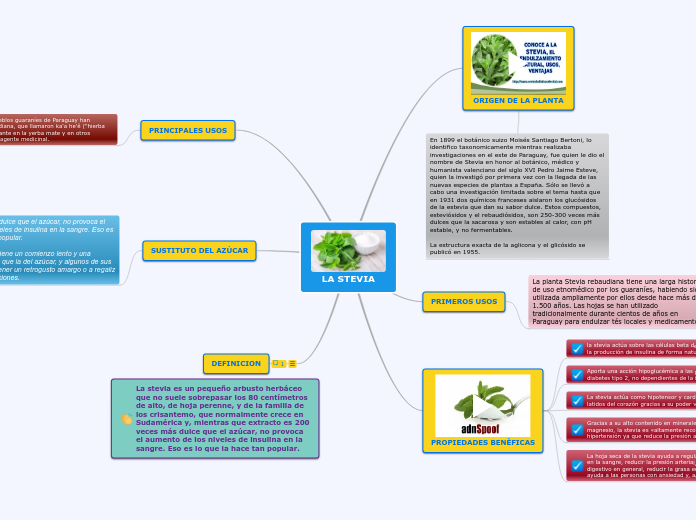
¿QUÉ ES?
OBJETIVO: analizar una sustancia líquida y una sólida y determinar qué sustancias son.
MUESTRA SÓLIDA
Calentar la muestra
OBJETIVO: Al calentar la muestra ver cómo reacciona.
MATERIALES:
- Placa calefactora
- Capsula
- Muestra
PROCEDIMIENTO:
- Limpiar material
- Meter la muestra en la cápsula
- Poner la capsula en la placa calefactora
- Ver resultados
RESULTADOS:
La muestra se ha fundido y creemos que es un azúcar por su apariencia
OBSERVACIONES Y CONCLUSIONES:
Al calentar la muestra hemos visto que se fundía y se quedaba como el caramelo.
Sabemos que es un azúcar y creemos que es galactosa por todas las pruebas que hemos hecho
Se hace caramelo
Es un tipo de azúcar (carbohidrato)
Prueba de Barfoed
OBJETIVO: determinar cualitativamente si la muestra sólida es un monosacárido o un disacárido realizando la prueba de Barfoed.
MATERIAL Y REACTIVOS:
- Tubo de ensayo
- Reactivo de Barfoed
- Placa calefactora
- Pinzas para tubo de ensayo
- Vaso de precipitados
- Agua
- Muestra sólida
- Sacarosa
PROCEDIMIENTO:
- Limpiar el material a utilizar
- Poner en una gradilla dos tubos de ensayo.
- Echar un poco de muestra sólida a uno de los tubos de ensayo. En el otro, como tubo de ensayo control, echaremos un poco de sacarosa (disacárido).
- Añadir unas gotas de reactivo Barfoed con una pipeta Pasteur en cada tubo de ensayo y agitar.
- Calentar Agua en un vaso de precipitados con la placa calefactora.
- Cuando el agua alcance los 70ºC se introducen los tubos de ensayo en el vaso de precipitado para que se calienten a baño maría.
- Esperar a que se dé la reacción.
- Si la muestra es un monosacárido aparecerá un precipitado rojo en el fondo del tubo de ensayo. Si no aparece, o tarda mucho en aparecer, es que se trata de un disacárido.
Protocolo/Fuente:
- https://ciencias.ua.es/es/extension-universitaria/documentos/extension-universitaria/ven-a-hacer-practicas/2017/bioquimica-identificacion-de-azucares.pdf
- http://bioquimicamarzo-julio.blogspot.com/2014/06/prueba-de-barfoed.html
RESULTADO: En el tubo de ensayo que contiene nuestra muestra parece un precipitado rojo.
OBSERVACIONES Y CONCLUISIONES
La Prueba de Barfoed sirve para distinguir monosacáridos reductores de disacáridos reductores, basándose en la velocidad de reacción; en los monosacáridos la formación del óxido cuproso es más rápido que en los disacáridos.
La reacción consiste en utilizar acetato cúprico y ácido acético en solución ácida con lo que los monosacáridos son capaces de reducir al cobre de manera más rápida y en condiciones menos drásticas.
Nuestra muestra se trata de un monosacárido ya que hay un precipitado rojo al fondo del tubo de ensayo.
Con las pruebas anteriores, casi con seguridad podemos afirmar que se trata de GALACTOSA.
Es monosacárido
Prueba de Fehling
OBJETIVO: ver cualitativamente si nuestra muestra sólida es un azúcar reductor o no.
El reactivo de Fehling se fundamenta principalmente, en su reacción, la oxidación de cobre, el poder reductor de los azúcares, sea este en monosacáridos, polisacáridos, aldehídos, y en ciertas cetonas.
MATERIAL Y REACTIVOS:
- Tubo de ensayo
- Mechero Bünsen
- Reactivo de Fehling: CuSO4 + NaOH
- Pipeta Pasteur
- Pinzas de tubos de ensayo
PROCEDIMIENTO
- Limpiar el material a utilizar.
- Poner 2 ml de la muestra en el tubo de ensayo.
- Añadir 2 ml de CuSO4 en el tubo de ensayo.
- Añadir a la mezcla 2 ml de NaOH en el tubo de ensayo.
- Calentar el tubo de ensayo con el mechero bünsen o a baño maría.
- Si cambia de color, de un tono azul a un rojo teja, la muestra será un azúcar reductor. De lo contrario, no será reductor.
Fuente:
https://sites.google.com/site/laboratoriosbioquimica/bioquimica-i/carbohidratos/reaccion-de-fehling
RESULTADO: Ha cambiado de color: de azul a rojo teja.
CONCLUSIONES Y OBSERVACIONES
La muestra sólida es un azúcar reductor.
https://sites.google.com/site/laboratoriosbioquimica/bioquimica-i/carbohidratos/reaccion-de-fehling
Es un azúcar reductor
Polarimetría
La polarimetría es la medición de la rotación angular de las sustancias ópticamente activas en un plano de luz polarizada.
Lo utilizamos para saber si el azúcar de la muestra sólida es destrógira o levógira.
Cuando la luz de sodio de la lámpara es proyectada a través del condensador filtro de color y polarizador se convierte en una luz polarizada plana y lineal, la cual pasa por la placa de cuarzo de media longitud de onda y se descompone en luz normal y anormal partiéndose su campo visual en tres partes (
figura 1).
https://laboratoriosuperior.files.wordpress.com/2015/10/tema-8b-polarimetrc3ada.pdf
Polarímetro
OBJETIVO: determinar cualitativamente si la muestra tiene actividad óptica o no y si la tiene, si es destrógira o levógira utilizando el polarímetro.
MATERIAL Y REACTIVOS:
- Disolución de la muestra sólida
- Polarímetro
- Intrumentos del polarímetro: tubo,...
PROCEDIMIENTO:
- Limpiar bien el material
- Preparar una disolución de la muestra sólida conocida
- Limpiar y homogeneizar el tubo del polarímetro con la disolución de la muestra.
- Llenar el tubo del polarímetro de forma que no quede ninguna burbuja en su interior y cerrar el tubo.
- Introducimos el tubo con la muestra en el compartimiento,
- Observamos a través del ocular, vemos una zona central brillante (u oscura) y dos zonas laterales oscuras (o brillantes), es decir tres campos visuales de diferente intensidad de iluminación.
- Dependiendo de si el campo oscuro son los laterales o el canal central, sabemos que es levógiro o destrógiro.
Protocolo/Fuente:
Instrucciones del aparato del laboratorio y https://laboratoriosuperior.files.wordpress.com/2015/10/tema-8b-polarimetrc3ada.pdf
RESULTADO:
Al observar por el polarímetro vemos una raya oscura central.
OBSERVACIONES Y CONCLUSIONES:
La muestra sólida presenta actividad óptica y es dextrógira.
Ha sido la primera vez que hemos usado el polarímetro por lo que primero hemos hecho pruebas con agua desionizada. Aún así, no sabíamos muy bien cómo usarlo pese a leernos las instrucciones y preguntar por lo que se ha podido cometer algún error en la observación.
+
Es un azúcar D
Solubilidad
OBJETIVO: Determinar la solubilidad del solido en distintos liquidos (ac. sulfúrico, etanol agua y acido clorídrico).
MATERIAL Y REACTIVOS:
- Tubo de ensayo
- Gradilla
- Agua destilada
- Etanol
- HCl
- Ac. sulfúrico
- Pipeta Pasteur.
PROCEDIMIENTO:
- Limpiar y secar un tubo de ensayo.
- Poner cuatro tubos en una gradilla y etiquetar cada tubo con la sustancia que vamos a introducir en ellos.
- Con una pipeta graduada introducir 3mL. aproximados (ya que es un ensayo cualitativo) de una de las sustancias en cada tubo.
Protocolo:
http://sgpwe.izt.uam.mx/files/users/uami/jaislocr/AFO/PRACTICA_2_Solubilidad_de_compuestos.pdf
RESULTADOS:
Nuestro solido problema se a disuelto en las cuatro sustancias.
CONCLUSIONES Y OBSERVACIONES
Como conclusión sabemos que nuestro liquido es soluble en los cuatro líquidos, por tanto tiene una gran solubilidad.
Al disolverse en agua podemos decir que es polar
Etanol
H2So4
Topic flotante
HCl
H2O
sí
OBJETIVO: Determinar la densidad del sólido mediante el método del picnómetro.
MATERIALES Y REACTIVOS
- Picnometro
- Balanza
- Espátula
- Embudo
- Papel
- Vidrio de reloj
- Muestra
- Agua desionizada
PROCEDIMIENTO:
- Limpiar el picnómetro.
- Llenar el picnómetro de agua y pesar.
- Llenar la mitad del picnómetro de agua y pesar.
- Llenar la mitad del picnómetro de agua y muestra y pesar.
- Llenar el picometro entero con agua + muestra y pesar.
Protocolo:
https://w3.ual.es/~mjgarcia/practica2.pdf
RESULTADOS: 1,5 g/ml
Desviación=0,316g/ml
CONCLUSIONES Y OBSERVACIONES
Posibles errores:
- Realizó la practica más de una persona.
- Sensibilidad de las balanzas.
- Cambios de Tª.
- La calibración del picnómetro se realizó a distinta temperatura que la práctica.
1,5 g/ml
Punto de fusión
OBJETIVO: determinar punto de fusión de nuestro solido.
MATERIAL Y REACTIVOS:
- Aparato Buchi
- Reloj de vidrio
- Muestra
- Capilar
PROCEDIMIENTO:
- Rellenar capilares de muestra, eintroducirlos en el Buchi.
- Seleccionar SETPOINT, GRADIENT, MAX POINT.
- Apuntar temperatura a la que empieza a fundir y a la que esta totalmente fundido y hacer media.
Protocolo/Fuente:
Pildoras didácticas.
RESULTADO:
Funde a 167ºC
Desviación=1,378ºC
OBSERVACIONES Y CONCLUSIONES:
El resultado si cuadra ya que coincide con el punto de fusion del Thiele.
167ºC
OBJETIVO: determinar el punto de fusion con el Thiele.
MATERIAL Y REACTIVOS:
- Tubo Thiele
- Hilo de alambre
- Capilar
- Vidrio de reloj
- Silicona liquida
- Embudo
- Termometro
- Mechero Bunchen
- Bombona
- Pinza, soporte y nuez.
- Tapon con agujero.
PROCEDIMIENTO:
- Montaje Thiele y llenado con silicona.
- Calentar con la llama por la parte del codo, el Thiele con la muestra dentro.
- Anotar punto de fusion en caso de que funda y cambiar a un termometro de mayor alcance si es necesario.
Protocolo/Fuente:
Pildoras didácticas.
RESULTADO:
La muestra funde a 168ºC
Desviación=168ºC
OBSERVACIONES Y CONCLUSIONES:
El punto de fusión es de 168ºC, a continuación lo acotaremos con el Buchi.
168ºC
Características Visuales
¿Olor?
Sí
Grueso
Blanco
Polvo
MUESTRA LÍQUIDA
¿Disolución?
LLEVAR A SEQUEDAD
OBJETIVO: Averiguar si la muestra líquida desconocida se trata de una disolución o una sustancia pura.
PROCEDIMIENTO:
- Limpiar y secar el material
- Verter un poco de la muestra líquida a un vaso de precipitados.
- Poner el vaso sobre la placa calefactora
- Darle calor.
- Si al evaporar el disolvente queda un residuo seco, se trata de una disolución. Si no queda ningún residuo seco, se trataría de una sustancia pura.
MATERIALES Y REACTIVOS:
- Placa calefactora
- Vaso de precipitado
- Muestra
RESULTADOS:
Hay residuo seco. Éste es blanco, tipo sal.
CONCLUSIÓN:
La muestra líquida se trata de una disolución.
Se procederá a realizar pruebas para identificar el residuo sólido.
¿hay resíduo seco?
Muestra pura
SÍ
Büchi con Oxalato de sodio
No se funde a 270ºC
Puede ser Oxalato de sodio
Si funde a 270ºC
No es Oxalato de sodio
pH de la disolución
7,34
pH de una disolución de oxalato de sodio conocida
OBJETIVO: Preparar una disolución de oxalato de socio de 0,074M y compararlo con el pH de la muestra líquida.
MATERIAL Y REACTIVOS
- PHmetro
- Vaso de precipitados
- Pez y recoge pez
- Frasco lavador
- Matraz aforado
- Vidrio de reloj
- Balanza
- Espátula
- Oxalato de sodio
PROCEDIMIENTO
- Limpiar el material
- Preparar la disolución de oxalato de sodio
- Calibrar el pHmetro
- Introducir el electrodo en la disolución
- Anotar el resultado
RESULTADO
pH: 7,61--> disolución de oxalato de sodio de 0,074M
pH: 7.34--> muestra líquida.
CONCLUSIÓN
pH de la disolución de oxalato de sodio y de la muestra es bastante parecida.
7,61
Identificación de sodio mediante llama
OBJETIVO: Identificar si la muestra tiene sodio mediante el método de identificación de metales mediante llama.
MATERIAL Y REACTIVOS:
- Mechero Bünsen
- Asa de siembra
- Vidrio de reloj
- Espátula
- Tubo de ensayo
- Oxalato de sodio
- Resto sólido de la muestra
- Agua
PROCEDIMIENTO
- Limpiar material
- Poner la muestra y el oxalato de sodio en vidrio de reloj.
- Introducir un poco de muestra en el tubo de ensayo y diluir. Lo mismo con el oxalato.
- Mojar el asa de siembra con la disolución
- Ponerlo sobre la llama.
Fuente/Protocolo: https://es.slideshare.net/EdithGonzalesOr/ensayo-a-la-llama-informe-de-laboratorio
RESULTADOS
La llama es amarilla
CONCLUSIÓN
La muestra tiene sodio.
Llama amarilla
Tiene Na
Subtema
Repetición Mufla
855ºC
Dos colores--> Verde yblanco
Podemos pensar que la muestra está contaminada. Posiblemente con algún compuesto con Cu ya que tiene una coloración verde.
Podríamos determinarlo mediante el espectrofotómetro.
¿MUESTRA CONTAMINADA CON Cu?
770ºC
Color gris
Carbonización
Tiene carbono
CO3-
OBJETIVO: A través de la efervescencia con el vinagre determinar si la muestra tiene carbonatos o no.
MATERIALES Y REACTIVOS
- Vaso de precipitado
- Espátula
- Vinagre
- Muestra
- Sodio carbonato
- Oxalato de sodio
PROCEDIMIENTO
- Limpiar el material.
- Coger 3 vasos de precipitado y echar en cada vaso una de las sustancias.
- Añadir vinagre (aprox. 1 ml).
- Ver si hay efervescencia o no.
RESULTADO
Nuestra muestra no tiene efervescencia.
CONCLUSIONES
Muestra muestra no tiene carbonatos ya que no tiene efervescencia.
Podemos pensar que es oxalato de sodio.
Se realizarán las pruebas correspondientes para poder descartar la hipótesis o confirmarla. Por ejemplo: identificación de Na en llama.
¿efervescente? (Pruebas con vinagre)
NO
Conductividad
Conductímetro
OBJETIVO: Determinar la conductividad de la muestra.
MATERIALES Y REACTIVOS
- Conductímetro
- Pez y recoge pez
- Vaso de precipitado
- Muestra
- Agua destilada
PROCEDIMIENTO:
- Calibrar el conductímetro
- Poner la muestra en un vaso de precipipitados.
- Introducir el conductímetro en el vaso.
- Anotar los resultados.
RESULTADOS: 21,96 mS
Desviación=0,32145mS
OBSERVACIONES Y CONCLUSIONES:
Hay conductividad, por lo que hay iones libres en la muestra.
21,96 mS
Determinación de iones (cualitativamente)
Se sospecha que se trata de una sal que contiene cloruros por lo que se realiza la prueba de Mohr.
Para descartar que se trate de CaCl2, tambiñen hemos realizado la prueba con EDTA. (https://www.upo.es/depa/webdex/quimfis/docencia/TAQ/curso0405/TAQP2_0405.pdf)
Ca2+
OBJETIVO: Determinar si hay iones de calcio libres en nuestra muestra líquida.
MATERIALES Y REACTIVOS
- Gradilla
- Tubo de ensayo
- Muestra
- EDTA
PROCEDIMIENTO:
- Limpiar el material
- Añadir en el tubo de esnayo un poco de nuestra muestra+ EDTA
- Agitar
- Ver reslutados
Fuente:
https://www.upo.es/depa/webdex/quimfis/docencia/TAQ/curso0405/TAQP2_0405.pdf
RESULTADOS: No ha precipitado, es decir, no hay iones de calcio
CONCLUSIONES Y OBSERVACIONES:
Al añadirle EDTA a la muestra vimos que no precipitó, por tanto, nuestra muestra no tiene iones de calcio
-
Cl-
OBJETIVO: determinar cualitativamente si hay cloruros (Cl-) libres en la disolución mediante el método de Mohr.
MATERIALES Y REACIVOS
- Gradilla
- Tubo de ensayo
- Agua desionizada
- AgNO3
- Muestra
PROCEDIMIENTO:
- Limpiar el material
- Meter un poco de nuestra muestra en el tubo de ensayo
- Añadir un poco de agua desionizada.
- Añadir unas gotas de AgNO3 con ayuda de una pipeta pasteur.
Fuente: http://ing.unne.edu.ar/pub/quimica/ab2/TP4.pdf
RESULTADOS: Aparece un precipitado blanco.
CONCLUSIONES Y OBSERVACIONES:
Hay precipitado blanco por lo que nos indica que hay cloruros libres en la disolución.
Estos cloruros pueden proceder del residuo seco de la muestra líquida o que la disolución no está realizada con agua desionizada.
+(precipitado blanco)
No agua desionizada
¿sal?
OBJETIVO: Determinar la densidad del residuo seco mediante el método del picnómetro.
MATERIALES Y REACTIVOS
- Picnometro
- Balanza
- Espátula
- Embudo
- Papel
- Vidrio de reloj
- Muestra
- Agua desionizada
PROCEDIMIENTO:
- Limpiar el picnómetro.
- Llenar el picnómetro de agua y pesar.
- Llenar la mitad del picnómetro de agua y pesar.
- Llenar la mitad del picnómetro de agua y muestra y pesar.
- Llenar el picometro entero con agua + muestra y pesar.
Protocolo:
https://w3.ual.es/~mjgarcia/practica2.pdf
RESULTADOS: 2,15 g/ml
Desviación=0,103642 g/ml
CONCLUSIONES Y OBSERVACIONES
Posibles errores:
- Realizó la practica más de una persona.
- Sensibilidad de las balanzas.
- Cambios de Tª.
- La calibración del picnómetro se realizó a distinta temperatura que la práctica.
2,15 g/ml
Mufla
OBJETIVO: Determinar si la muestra se calcina o se funde.
MATERIALES Y REACTIVOS
- Capsula de porcelana
- Mufla
- Pinzas
- Guantes termoresistentes (Mufla)
- Muestra
PROCEDIMIENTO:
- Meter la muestra en la capsula
- Meter la cápsula a la Mufla determinando la termperatura deseada.
RESULTADOS:
a 600ºC -->No se ha visto ningún cambio.
a 770ºC--> No se ha visto ningún cambio.
a 810ºC--> No se ha visto ningún cambio.
a 1105ºC--> Coloración algo gris.
CONCLUSIONES Y OBSERVACIONES:
La muestra tiene un punto de fusión muy alto.
Puede que no se trate de una sustancia pura, es decir, que se haya contaminado en el proceso, o desde el inicio.
Pensamos que es una sal. Las sales tienen un punto de fusión muy alto por lo que no nos es posible determinar el punto exacto en el Büchi de éste laboratorio.
No se funde/No cambios
600
530
No tiene cambios
Punto de Fusión
OBJETIVO:
Determinar el punto de fusión del resto sólido de la muestra líquida.
Se realizará primero Thiele para determinar aproximadamente a qué temperatura se funde y para ajustar su punto de fusión se utilizará Büchi.
Büchi
OBJETIVO: Determinar el punto de fusión de la muestra con el método büchi.
MATERIALES Y REACTIVOS
- Capilar
- Büchi
- Vidrio de reloj
- Muestra
PROCEDIMIENTO:
- Rellenar capilares
- Meterlos en Büchi
- Seleccionamos; setpoint, gradiente y max point
- Anotar la Tª cuando empieze a fundirse y cuando está totalmente fundido
RESULTADO: No se ha fundido
CONCLUSIONES Y OBSERVACIONES:
LLegamos a 395ºC y no se fundió.
Creemeos que la muestra está contaminada, y que debería de fundirse a 270ºC
No se funde a 395ºC
Thiele
OBJETIVO: Determinar el punto de fusión del resto sólido de la muestra líquida usando Thiele.
MATERIALES Y REACTIVOS:
- Thiele
- Soporte
- Pinzas
- Nuez
- Termometro
- Tapon
- Capilar
- Vidrio de reloj
- Silicona
- Muestra
PROCEDIMIENTO:
- Montar el soporte
- Meter la muestra en los capilares
- Juntar el capilar con el termómetro usando una arandela de silicona o un hilo de cobre.
- Meter silicona en el Thiele.
- Meter el termómetro con el capilar en un tapón de silicona acorde al Thiele, y colocarlo.
- Colocar y encender el mechero Bünsen
- Anotar la temperatura a la que empieza a fundirse la muestra y a la que termina de fundirse.
Fuente:
http://riubu.ubu.es/bitstream/10259.3/66/8/24.3_Determinaci%C3%B3n_de_Puntos_de_Fusi%C3%B3n.pdf
RESULTADO: No hay datos ya que a 270ºC el tapón de silicona empezó a fundirse.
CONCLUSIONES Y OBSERVACIONES:
Al no tener en el laboratorio un termómetro que mida temperaturas mayores a 300ºC , de determinará el punto de fusión en el Büchi a partir de la última temperatura, 270ºC.
Es importante coger el termómetro adecuado. Al inicio, escogimos uno de 150ºC por lo que a mitad de la práctica tuvimos que cambiarlo.
No se funde
Se fundió el tapón
¿Muestra pura?
Primero, consideramos que la muestra líquida se trata de una muestra pura. Hacemos los siguientes ensayos mientras ponemos parte de la muestra a evaporar sobre una placa calefactora.
pH
OBJETIVO: determinar el pH de la muestra líquida con el pHmetro.
MATERIALES Y REACTIVOS
- Vaso de precipitado
- Pez y recoge pez
- Magnetoagitador
- Termometro
- Electrodo
- Agua destilada
- Muestra
PROCEDIMIENTO:
- Calibrar el pHmetro.
- Limpiar el material.
- Verter la muestra líquida en un vaso de precipitados.
- Introducir el phmetro en la muestra problema.
- Medir el pH y anotar el resultado.
Fuete:
http://www.iesjovellanos.com/archivos/Determinacion_del_pH.1173559178.pdf
RESULTADO: pH=7.336
Desviación=0,025166
CONCLUSIONES Y OBSERVACIONES:
El pH es prácticamente neutro, ligeramente básico. Podemos considerar que se trata de un líquido neutro.
7,336
Pto. Congelación
OBJETIVO: determinar el punto de congelación de la muestra líquida.
MATERIALES Y REACTIVOS:
- Vaso de precipitado
- Soporte
- Pinzas
- Nuez
- Termómetro
- Hielos
- Muestra
- Sal
- Balnza
- Vidrio de reloj
- Espátula
CON LA MEZCLA FRIGORÍFICA:
PROCEDIMIENTO:
1- Limpiar un vaso de precipitado.
2- Verter nuestra muestra en el vaso
3- Picar aproximadamente 100g de hielo
4- Introducirlo en un vaso de precipitados mayor.
5- Introducir el vaso con nuestra muestra problema en el el vaso de precipitados con hielo
6- Ir añadiendo sal al hielo.
7- Introducir un termómetro en la muestra líquida (montaje con el termómetro).
8- Anotar la temperatura cuando empiece a formar cristales, se empiece a congelar.
Protocolo:
http://www.her.itesm.mx/webtec/her/pc/3002/Recursos/2/S21/AC21.pdf
RESULTADO: -3 ºC
CONCLUSIONES Y OBSERVACIONES
La muestra líquida se congela a poco menos que 0ºC, a -3ºC, punto de congelación bajo. Éste punto es parecido al punto de congelación del agua.
Las condiciones en las que se hizo la mezcla frigorífica, no fueron las óptimas ya que el ensayo se realizo entre varias personas, la temperatura del laboratorio era relativamente alta formándose una capa de escarcha en el vaso de precipitados al congelarse la humedad del ambiente.
-3ºC
Pto. Ebullición
OBJETIVO: determinar a qué temperatura ebulle nuestra muestra.
MATERIALES Y REACTIVOS:
- Soporte
- Nuez
- Pinza
- Placa calefactora
- Termómetro
- Vaso de precipitado
- La muestra
PROCEDIMIENTO:
- Limpiar y secar el material
- Introducir aproximadamente 70ml de la muestra líquida en un vaso de precipitados.
- Hacer el montaje del termómetro: base, nuez, pinza de termómetro y termómetro.
- Poner el vaso en la placa calefactora.
- Introducir el termómetro en el vaso de forma que esté en el líquido y no toque ninguna de las paredes del vaso.
- Anotar la temperatura cuando empiece a ebullir.
Protocolo:
http://docencia.udea.edu.co/cen/tecnicaslabquimico/02practicas/practica06.htm
RESULTADO: 91,25 ºC
CONCLUSIONES Y OBSERVACIONES:
Esta característica no en muy determinante para poder identificar qué es.
El punto de ebullición es menor que el punto de ebullición del agua.
92ºC
Densidad
OBJETIVO: Determinar la densidad del líquido problema con 3 métodos: picnómetro, densímetro e inmersor.
MATERIALES Y REACTIVOS:
- Probeta
- Inmersor
- Picnómetro
- Vaso de precipitado
- Agua desionizada
- La muestra
PROCEDIMIENTO Y RESULTADOS:
Se detalla en cada uno de los métodos.
CONCLUSIONES Y OBSERVACIONES:
La densidad del líquido problema son parecidos. Es poco más denso que el agua.
Inmersor
PROCEDIMIENTO:
- Limpiar el material
- Calibrar el inmersor:
- Pesar una probeta llena de agua desionizada.
- Sumergir el inmersor en la probeta con el agua desionizada y pesar.
- Anotar los datos en una tabla.
- Calcular el volumen real del inmersor.
- Medir la densidad de la muestra líquida:
- Llenar la probeta con la muestra líquida y pesar.
- Sumergir el inmersor en la muestra líquida y pesar.
- Anotar los datos en una tabla.
- Calcular la densidad del líquido teniendo en cuenta el volumen del inmersor.
PROTOCOLO: http://www.ugr.es/~andyk/Docencia/TEB/Guiones/08.doc
RESULTADO: 1.017 g/ml
Desviación=0,00044753 g/ml
1,017 g/ml
Densímetro
PROCEDIMIENTO:
- Lavar el material.
- Homogeneizar la probeta con el líquido problema.
- Llenar la probeta con la muestra.
- Elegir el densímetro e introducirlo en la probeta (
- Si al soltarlo se va hacia el fondo, se elige otro densímetro con rango de densidades mayores.
- Se deja sobre la superficie del líquido y damos un pequeño giro para que caiga girando.
- Cuando el densímetro se para, se puede medir su escala sin que se quede adherido a la pared de la probeta.
- Hacer al lectura de escala: los ojos tienen que estar a la altura del líquido.
Fuente:
http://www.gisiberica.com/densimetr%EDa%20are%F3metros/fundamento_teorico.htm
RESULTADO: 1.021 g/ml
1,021 g/ml
Picnómetro
PROCEDIMIENTO:
- Secar y pesar el picnómetro.
- Llenar el picnómetro con el líquido problema y pesar.
- Anotar los datos en una tabla.
- Hacer la resta y el resultado será el resultado la masa del líquido.
- Para calcular la densidad, la masa del líquido muestra entre el volumen del picnómetro.
Fuente:
https://quercuslab.es/blog/metodo-del-picnometro-para-determinar-densidades/
RESULTADO: 1.018 g/ml
Desviación=0,000127 g/ml
1,018 g/ml
Características visuales
Los descriptores visuales describen las características visuales del contenido.
Describen características elementales tales como la forma, el color, la textura o el movimiento, entre otros.
Incoloro
Inoloro
Líquido no viscoso